题目内容
【题目】NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+X↑。X的化学式为______。
2NaOH+Cl2↑+X↑。X的化学式为______。
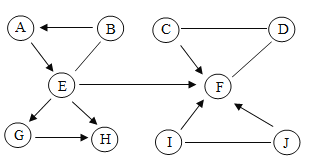
(2)为了探究NaOH样品中是否存在NaCl、Na2CO3杂质,设计如下实验方案:
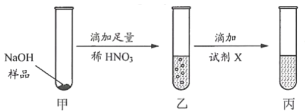
注:AgCl是白色固体,难溶于水和稀HNO3。
①乙中有无色无味气体产生,证明样品中含有Na2CO3。产生气体的化学方程式为______。
②试剂X为_____溶液;可证明NaCl存在的现象是______。
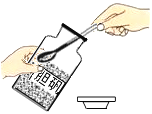
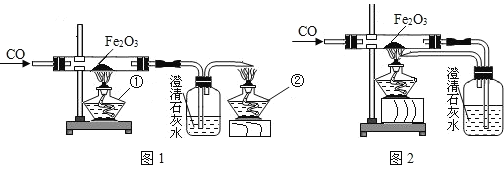
(3)某兴趣小组试图通过测定生成的CO2质量确定因久置而变质的NaOH固体中Na2CO3的质量分数,设计了如图所示装置并进行如下实验:
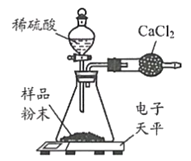
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m2。
①球形干燥管中不用NaOH固体而用CaCl2固体的原因是______。
②小明同学认为(m1-m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是______。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H2SO4的质量为______(写出计算过程)。
【答案】H2 2HNO3+Na2CO3=2NaNO3+H2O+CO2↑ 硝酸银 丙中产生白色沉淀 CaCl2不吸收CO2,而NaOH吸收CO2 锥形瓶内有残留的二氧化碳气体,生成的二氧化碳气体没有全部排出锥形瓶,导致(m1-m2)比实际生成的CO2质量偏小 4.9g
【解析】
(1)由质量守恒定律可知,反应前后Na、Cl、H、O原子的个数分别为:2、2、4、2,2、2、2、2,故X的化学式为H2;
(2)①硝酸与碳酸钠反应生成硝酸钠、水和二氧化碳,反应的化学方程式为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑;
②为检验氯离子,试剂X为硝酸银溶液;可证明NaCl存在的现象是:丙中产生白色沉淀;
(3)①球形干燥管中不用NaOH固体而用CaCl2固体的原因是:CaCl2不吸收CO2,而NaOH吸收CO2;
②小明同学认为(m1-m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是:锥形瓶内有残留的二氧化碳气体,生成的二氧化碳气体没有全部排出锥形瓶,导致(m1-m2)比实际生成的CO2质量偏小;
(4)设一定量石油产品中所含H2SO4的质量为x。

![]()
x=4.9g
答:这一定量石油产品中所含H2SO4的质量为4.9g。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验方法不能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 除去MnO2固体中的KCl | 加水溶解,过滤,洗涤,干燥 |
B | 鉴别化肥NH4Cl和KNO3 | 取少量化肥加入熟石灰粉末研磨,闻气味 |
C | 配制质量分数为6%的NaCl溶液 | 称取3.0g NaCl,加入50.0mL水使之溶解 |
D | 鉴定本地雨水是否为酸雨 | 用pH计测定雨水的pH |
A. AB. BC. CD. D