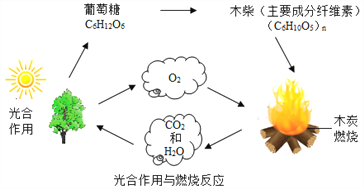
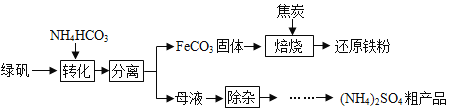
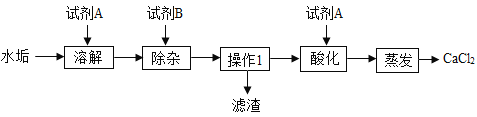
��Ŀ����
����Ŀ����һ�ձ���ʢ��4.33gNaCl��Na2SO4��ɵĹ����������20g��ˮʹ����ȫ�ܽ⡣����������μ���һ����������������BaCl2��Һ28g��ǡ����ȫ��Ӧ�����ˣ����ó�����������ͼ��ʾ������������ȷ��0.1%��(��ѧ����ʽΪ��Na2SO4+BaCl2=BaSO4��+2NaCl)
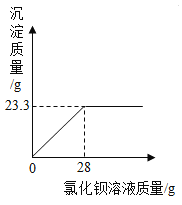
��1��ԭ���������������Ƶ�����������
��2����Ӧ��������Һ�����ʵ�����������
���𰸡�(1)32.8%��(2)8.2%
��������
![]() �⣺��ԭ������������Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy
�⣺��ԭ������������Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy
![]()
![]()
ԭ���������������Ƶ���������:![]() ��100%=32.8%
��100%=32.8%
ԭ�����������Ȼ��Ƶ�����:4.33g-1.42g=2.91g
��Ӧ��������Һ������Ϊ��4.33g+20g+28g-2.33g=50g
��Ӧ��������Һ�����ʵ���������:![]() ��100%=8.2%
��100%=8.2%
��ԭ���������������Ƶ���������Ϊ32.8%����Ӧ��������Һ�����ʵ���������Ϊ8.2%��

 ��У����ϵ�д�
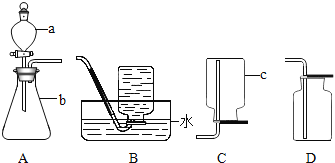
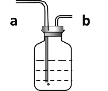
��У����ϵ�д�����Ŀ��ij��ȤС�������طֽⷴӦ�Ĵ��������о�������ͬ�ļ�����������ɱ���ʵ�飺
��� | ���������/g | ���� | ��������/g | �ռ�50mLO2����ʱ��/s |
ʵ��1 | 5 | �� | �� | 171 |
ʵ��2 | 5 | �������� | 0.5 | 49 |
ʵ��3 | 5 | ������ | 0.5 | 58 |
ʵ��4 | 5 | �Ȼ��� | 0.5 | 154 |
(1)����ʵ��1��Ŀ����____________��
(2)��������3�ִ����Ĵ�Ч����ѵ���_________��
(3)д��ʵ����������������������ֱ���ʽ__________��
(4)��ʵ��1��ʵ��4��֪���Ȼ���____(����������������)�����á�ά�ּ����������䣬��ʵ��1�ټ����ռ�50mLO2������ʱ����������171s������ԭ��_____________��
(5)Ҫ�Ƚ�����طֽⷴӦ�в�ͬ�����Ĵ�Ч�������˿���ͨ�������ռ�50mLO2����ʱ����ʵ���⣬������ͨ������_____________��