题目内容
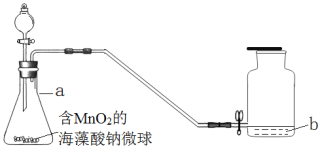
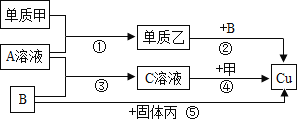
【题目】现有一瓶含NaCl杂质的Na2CO3样品,某同学设计了一种测定其纯度的方法,装置如图1,其中A容器中盛有样品10.0g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因______。
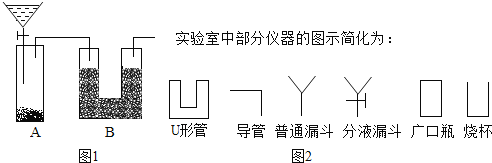
(2)通过仔细分析,该同学重新设计了一套实验装置如图3,请回答有关问题:(可供选择的试剂还有Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)

①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂_____。
②A装置的广口瓶中应加入的试剂是______;该装置的作用是______。
③如果实验后测得E装置质量增重3.52g,则该Na2CO3试样的纯度为______。
(3)测定该Na2CO3试样纯度的方法有多种,请你利用不同的反应原理再设计一套方案。要求写出实验操作流程和试样中Na2CO3纯度的表达式。(试剂任选)
操作流程按下列图4所示表述:
①操作流程为(图5):______。
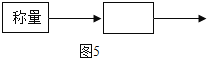
②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:______。
【答案】①A中产生的CO2气体未全部进入B;②CO2中混有的少量水蒸气进入B;③B吸收了空气中的水蒸气、CO2 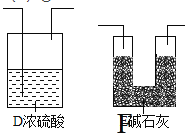 Zn片和蒸馏水 利用A中生成的H2将C中的CO2全部排入E中被碱石灰吸收 84.8%
Zn片和蒸馏水 利用A中生成的H2将C中的CO2全部排入E中被碱石灰吸收 84.8% ![]()
![]()
【解析】
(1)空气中的二氧化碳和水会进入装置B中,与碱石灰反应,碳酸钠与稀硫酸反应生成硫酸钠、二氧化碳和水,二氧化碳会从稀硫酸中携带水蒸气,进入装置B,被碱石灰吸收,也有可能,A中产生的二氧化碳未全部被碱石灰吸收,从而使实验产生误差,所以结果数据出现了较大偏差,可能的原因是:①A中产生的CO2气体未全部进入B;②CO2中混有的少量水蒸气进入B;③B吸收了空气中的水蒸气、CO2;
(2)①浓硫酸有吸水性,所以进入碱石灰之前,需要先用浓硫酸将水蒸气吸收,还要防止空气中的水蒸气和二氧化碳进入碱石灰中,所以需要补充装置的虚框内画出合适的简图为: ;
;
②题中所给的浓硫酸需要稀释,实验室用锌和稀硫酸反应生成氢气,氢气可以将二氧化碳排出,减小实验误差,所以A装置的广口瓶中应加入的试剂是:Zn片和蒸馏水,该装置的作用是:利用A中生成的H2将C中的CO2全部排入E中被碱石灰吸收;
③E装置中增加的质量就是反应生成的二氧化碳的质量。
设参加反应的碳酸钠的质量为x
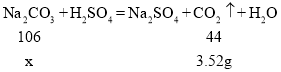
![]() x=8.48g
x=8.48g
所以该Na2CO3试样的纯度为:![]() ;
;
(3)①碳酸钠和氯化钙反应会生成碳酸钙沉淀,通过沉淀的质量计算出碳酸钠的质量,再求出质量分数,所以操作流程是:![]() ;
;
②实验时称量样品的质量为a克,所测物质的质量为b克,所以碳酸钙质量为b,设参加反应的碳酸钠质量为y,所以
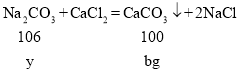
![]() y=
y=![]() g
g
所以碳酸钠的质量分数为: 。
。

 名校课堂系列答案
名校课堂系列答案【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。