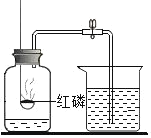
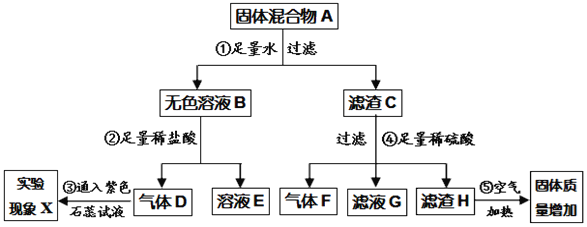
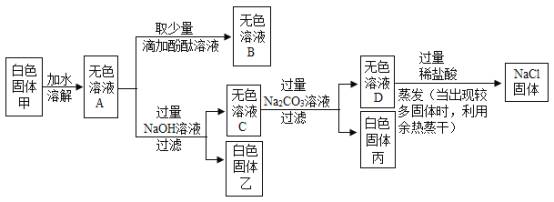
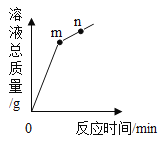
题目内容
【题目】已知A、B、C、D、E是初中化学常见的物质。A是胃酸的主要成分,D是一种钠盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产,C、E为氧化物。它们间的相互关系如图所示(“—”表示两种物质能发生化学反应,“→”表示两种物质间的转化关系,部分反应物、生成物及反应条件已略去)。请回答。
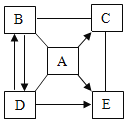
(1)E的化学式是_____;C的一种用途是_____。
(2)若A→E反应生成黄色溶液,写出该反应的化学方程式_____。
(3)D→B反应的化学方程式是_____。
【答案】H2O 灭火或气体肥料(合理即可) Fe2O3+6HCl=2FeCl3+3H2O或3HCl+Fe(OH)3=FeCl3+3H2O(合理即可) Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【解析】
A、B、C、D、E是初中化学常见的物质,A是胃酸的主要成分,A是盐酸,D是一种钠盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产,D是碳酸钠,C、E为氧化物,B和碳酸钠可以互相转化,氢氧化钠与二氧化碳反应生成碳酸钠和水,氢氧化钙和碳酸钠生成碳酸钙和氢氧化钠,B是氢氧化钠,C是二氧化碳,E是水。
(1)B和碳酸钠可以互相转化,B是氢氧化钠,C是二氧化碳,E是水,E的化学式是H2O;C的一种用途是灭火或气体肥料。
(2)若A→E反应生成黄色溶液,反应是氧化铁和盐酸生成氯化铁和水,盐酸和氢氧化铁生成氯化铁和水,该反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O或3HCl+Fe(OH)3=FeCl3+3H2O。
(3)D→B反应是氢氧化钙和碳酸钠生成碳酸钙和氢氧化钠,反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。

【题目】碳酸钠、碳酸氢钠是生活中两种常见的重要的盐。
(1)碳酸钠(俗称纯碱、苏打)与碳酸氢钠(俗称_____),均为________色固体,水溶液均呈_______性,向它们的水溶液中分别滴入无色酚酞试液,酚酞试液均变红色。
(2)碳酸钠、碳酸氢钠均可与稀盐酸反应,其中碳酸钠与稀盐酸反应的化学方程式为_____。但是,碳酸钠、碳酸氢钠与稀盐酸反应产生二氧化碳的速率是否相同?校兴趣小组同学针对于此,展开探究:
(方案设计)
①甲设计的实验如图1所示,实验时,同时全部推出足量稀盐酸后,观察到图2所示现象。于是他得出______和稀盐酸反应产生二氧化碳较快的结论。
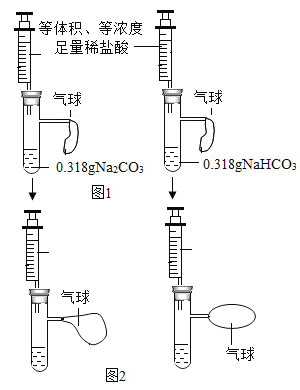
②乙同学通过计算可知:0.318 g碳酸氢钠约产生0.167 g二氧化碳,而0.318 g碳酸钠产生二氧化碳的质量为______g,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸作用,碳酸氢钠产生二氧化碳的质量更多,显然甲同学的设计不妥,应取含碳元素质量相同的碳酸钠和碳酸氢钠进行实验。若碳酸钠的质量仍为0.318g,应称取碳酸氢钠的质量为_______g。
③小组同学在老师指导下设计了图3所示实验。连通管除消除稀盐酸滴入占有体积引起的误差,还有______的作用。
分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液)以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,广口瓶内压强随时间变化如图4所示,溶液颜色变化记录如表1。
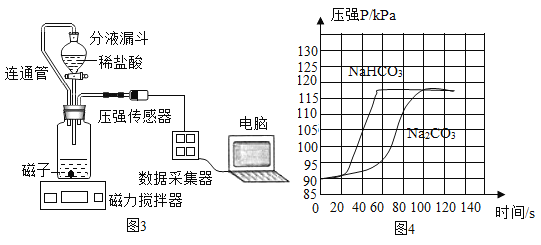
表1:
滴入酚酞溶液 | 滴入稀盐酸,溶液颜色变化 | |
碳酸钠溶液 | 红色 | 红色→浅红色→无色 |
碳酸氢钠溶液 | 浅红色 | 淺红色→无色 |
(实验结论)分析图4所示的实验数据可得到:相同条件下,碳酸氢钠与稀盐酸反应产生二氧化碳速率更快,你判断的理由是_______。
(实验反思)小组同学分析表1实验现象和图4数据,得出碳酸钠能与稀盐酸反应产生二氧化碳,反应是分步进行的。第一步发生的化学反应方程式是:_______,第二步发生的反应是:NaHCO3+HCl=NaCl+H2O+CO2↑。
【题目】某同学查阅资料得知,实验室常用电石(主要成分是CaC2)与水反应制取乙炔(C2H2),反应的化学方程式为CaC2 +2H2O==Ca(OH) 2 +C2H2↑(电石中的杂质不溶于水且不与水反应,也不与Na2CO3溶液反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH
猜想二:NaOH、Na2CO3
猜想三:NaOH、Ca(OH) 2
[实验验证]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向其中加入过量稀盐酸 | 无气泡产生 | 猜想________不成立 |
实验二 | 取少量滤液于试管中,向其中滴加适量碳酸钠溶液 | _________ | 猜想三成立,发生反应的化学方程式为_______ |
[拓展延伸]
(1)若向CuCl2溶液中加入少量CaC2充分反应,可观察到有气泡产生,且_______。
(2)实验室保存电石应注意__________________________。