题目内容
【题目】普通白铜是铜镍合金,在工业上用途广泛。由于外观与银极为相似,常被不法商人用来冒充白银谋取暴利。已知白铜中的金属镍与稀盐酸反应的化学方程式为![]() ,为了鉴别真伪,某校化学兴趣小组取该样品40g分四次加入盛有100g未知浓度的盐酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:
,为了鉴别真伪,某校化学兴趣小组取该样品40g分四次加入盛有100g未知浓度的盐酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 10 | 10 | 10 | 10 |
烧杯和烧杯内物质的总质量/g | 159.9 | 169.8 | m | 189.7 |
(1)![]() ________________﹔
________________﹔
(2)所用盐酸溶液的溶质质量分数是________________;
(3)样品中铜的质量分数是________________。
【答案】179.7 ![]()
![]()
【解析】
(1)由于第一次和第二次可以看出加入10g样品对应总质量都是减少0.1g,按照这个规律第三次加入应该也是减少0.1g,烧杯和烧杯内物质的总质量为179.7g,
(2)分析数据可知,生成![]() 的总质量为
的总质量为![]()
设30g样品中镍的质量为x,HCl的质量为y,

x=8.85g
y=10.95g
所用盐酸溶液的溶质质量分数为![]() ×100%=10.95%。
×100%=10.95%。
(3)样品中铜的质量分数为![]() ×100%=70.5%
×100%=70.5%
答:(1)m=179.7;
(2)所用盐酸溶液的溶质质量分数是 10.95%;
(3)样品中铜的质量分数是 70.5%。

【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(![]() )为黑色固体。
)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:![]() .
.
(进行实验)
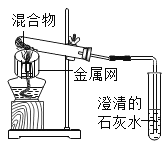
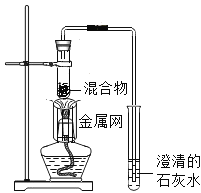
实验l:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1-1 | 1-2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1-2装置进行实验。
序号 | 本炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2-1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2-2 | 1:10 | 混有很少量黑色物质 | |
2-3 | 1:11 | 混有极少量黑色物质 | |
2-4 | 1:12 | 无黑色物质 | |
2-5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)实验1-2中,证明![]() 生成的方程式是_____。
生成的方程式是_____。
(2)实验1的目的是_____。
(3)实验2的结论是_____。
(反思与评价)
(4)实验2没有进行质量比为1:14的实验,理由是_____。
(5)为检验2-4的红色固体中是否含![]() ,所需试剂是_____。
,所需试剂是_____。