题目内容
【题目】一定质量的甲乙丙三种金属分别与足量的等浓度的稀硫酸完全反应,都生成+2 价的金属硫酸盐,产生 H2 的质量与反应时间关系如图所示,则下列说法不正确的是( )

A.反应消耗硫酸的质量:甲>乙=丙
B.若甲和乙质量相等,则相对原子质量:甲>乙
C.甲最先反应完,丙最后反应完
D.无法比较所得溶液中硫酸盐的质量分数
【答案】B
【解析】
金属与稀硫酸反应,金属活动性越强,反应速率越快,若都生成+2 价的金属硫酸盐,方程式可以写成![]() ,因为稀硫酸是足量的,故生成氢气量越多消耗的稀硫酸的量越多,当甲和乙质量相等,根据方程式,可以求出氢气的质量进行比较。
,因为稀硫酸是足量的,故生成氢气量越多消耗的稀硫酸的量越多,当甲和乙质量相等,根据方程式,可以求出氢气的质量进行比较。
A、金属与稀硫酸反应,都生成+2 价的金属硫酸盐,故方程式可以写成![]() ,每生成1份氢气需要消耗1份的稀硫酸,故可以通过氢气的质量来比较消耗的稀硫酸的质量,氢气的质量:甲>乙=丙,则稀硫酸的质量:甲>乙=丙,故不符合题意;
,每生成1份氢气需要消耗1份的稀硫酸,故可以通过氢气的质量来比较消耗的稀硫酸的质量,氢气的质量:甲>乙=丙,则稀硫酸的质量:甲>乙=丙,故不符合题意;
B、若甲和乙质量相等为m,由![]() 可得,甲生成氢气的质量为
可得,甲生成氢气的质量为![]() ,乙生成氢气的质量为
,乙生成氢气的质量为![]() ,由图像可知甲生成的氢气大于乙的,即
,由图像可知甲生成的氢气大于乙的,即![]() >
>![]() ,则
,则![]() ,故符合题意;
,故符合题意;
C、每条折线折点之后,氢气的质量未增加,可知金属已经完全反应,横坐标表示时间,根据折点的先后顺序,可知甲最先反应完,丙最后反应完,故不符合题意;
D、溶液中硫酸盐的质量分数=![]() ,从题目中可知金属的质量未知,溶液的总质量位置,无法判断,故不符合题意。
,从题目中可知金属的质量未知,溶液的总质量位置,无法判断,故不符合题意。
故选B。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】小明的大爷是种植蔬菜专业户,去年购买的化肥,由于外装上的字迹看不清,只记得是硫酸钾、碳酸氢铵、氯化铵中的一种,大爷正为此烦恼。
(1)小明利用学过的化学知识,设计了如下实验方案帮助鉴别化肥。
实验步骤 | 实验现象 | 实验结论 |
取上述化肥少量于一容器中,加入少量熟石灰粉末,混合研磨 | 嗅到_____。 | 该化肥不是硫酸钾 |
(2)小明假期到农田施肥时,发现撒落在地上的碳酸氢铵在阳光的照射下很快会消失,同时闻到浓烈的刺激性气味。他很好奇,返校后和同学们进行探究,请你一同参与:
(提出问题)温度较高时,碳酸氢铵能分解吗?产物是什么?
(猜想与假设)碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气。
收集资料:氨气能使湿润的红色石蕊试纸变蓝。
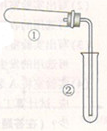
实验设计:小明设计了如图所示的装置进行实验(夹持仪器省略)。

①根据现象:干燥的红色石蕊试纸变蓝,证明实验后生成了_____。
②装置B中澄清石灰水_____,证明产物中有二氧化碳生成,发生反应的化学方程式为_____。
③小红同学认为若将装置B中澄清石灰水改为NaOH溶液,再通过实验验证B中产物,也可以证明碳酸氢铵分解后有二氧化碳生成。
请你帮她设计并完成验证B中产物的实验:
实验步骤 | 实验现象 |
取装置B中溶液少许于试管中,滴加稀盐酸 | _____ |
(实验结论)碳酸氢铵受热易分解,写出反应的化学方程式_____。
(实验反思)根据以上实验,你认为碳酸氢铵化肥在存放时应注意的问题是_____(写一条)。通过探究找到了鉴别化肥的方法。
【题目】普通白铜是铜镍合金,在工业上用途广泛。由于外观与银极为相似,常被不法商人用来冒充白银谋取暴利。已知白铜中的金属镍与稀盐酸反应的化学方程式为![]() ,为了鉴别真伪,某校化学兴趣小组取该样品40g分四次加入盛有100g未知浓度的盐酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:
,为了鉴别真伪,某校化学兴趣小组取该样品40g分四次加入盛有100g未知浓度的盐酸溶液的烧杯(已知烧杯质量为50g)中,充分反应后,测得烧杯和烧杯内物质的质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 10 | 10 | 10 | 10 |
烧杯和烧杯内物质的总质量/g | 159.9 | 169.8 | m | 189.7 |
(1)![]() ________________﹔
________________﹔
(2)所用盐酸溶液的溶质质量分数是________________;
(3)样品中铜的质量分数是________________。