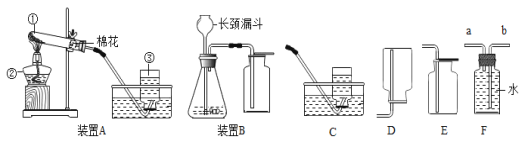
题目内容
【题目】某固体混合物含有碳酸钙、氧化钙、铁粉中的一种或几种。取该固体粉末18.4g,按下列流程进行实验,其中说法正确的是( )
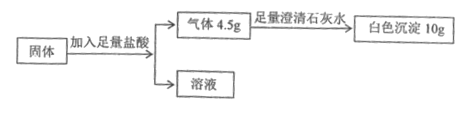
A. 铁粉的质量为5.6g
B. 氧化钙与铁粉的质量比为2:1
C. 生成氢气的质量为0.2g
D. 溶液中氯化钙的质量为22.2g
【答案】BD
【解析】
根据通入足量澄清石灰水会产生白色沉淀10g,
设参加反应的二氧化碳的质量为x:

![]()
x=4.4g,则原混合物中碳酸钙的质量为10g,
故气体中氢气的质量为:4.5g-4.4g=0.1g
设原混合物中铁粉的质量为y,
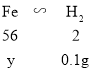
![]()
y=2.8g,则原混合物中氧化钙的质量为:18.4g-10g-2.8g=5.6g,
所以:A、C是错误的,根据氧化钙的质量为5.6g,铁粉的质量为2.8g,所以B选项正确,根据原混合物中碳酸钙的质量为10g,氧化钙的质量为5.6g,所以钙元素的质量为:10g×![]() ×100%+5.6g×
×100%+5.6g×![]() ×100%=8g,所以生成的氯化钙质量为:8g÷
×100%=8g,所以生成的氯化钙质量为:8g÷![]() =22.2g,所以D选项正确,故选BD。
=22.2g,所以D选项正确,故选BD。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】 小明对妈妈杀鱼时从鱼肚内取出的鳔(如图)产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A:用医用注射器抽取鳔内气体,测量其体积;B:在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
你认为这两种方法中不合理的是_____,理由:_____.写出与理由相关的化学方程式_____.
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设.
方法 | 现象 | |
验证鳔内含O2 | _____ | _____ |
验证鳔内含CO2 | _____ | _____ |
【题目】某同学发现一瓶没有塞上瓶塞的过氧化氢溶液,对该溶液中是否有过氧化氢的剩余,与同学们一起进行如下探究实验。
(猜想与假设)
猜想⑴:该溶液中有过氧化氢的剩余。猜想⑵:该溶液中没有过氧化氢的剩余。
(方案讨论)为了验证猜想,甲、乙、丙三同学分别提出如下方案
甲:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想(1)成立,若带火星的木条不复燃,猜想(2)成立.
同学们认为此方案不行,原因是____________________。
乙:取少量二氧化锰于试管中,加入与甲等量的试剂,若有气泡产生,则猜想(1)成立,若无气泡产生则猜想(2)成立,理由是______(写化学反应的文字表达式)
丙:
操作 | 现象 | 结论 |
取与甲等量试剂于试管中,加热,伸入带火星的木条 | __________________ | 猜想(1)成立 |
(反思与交流)1、敞口放置的试剂容易变质,所以要______保存。
2、二氧化锰在过氧化氢的分解过程中起________作用。除此之外能改变化学反应速率的方法还可以______________