题目内容
【题目】下图为从含有![]() 和
和![]() 的废液中回收
的废液中回收![]() 和
和![]() 溶液的流程,据图回答问题。
溶液的流程,据图回答问题。
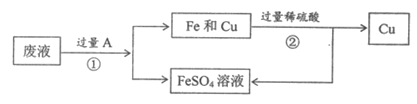
①中操作的名称是________。
②中反应的化学方程式为________,该反应属于基本反应类型中的________反应。
③不考虑过程中铁元素的损耗,最终得到的![]() 溶液中铁元素的质量________(填“<”、“=”或“>”)废液中铁元素的质量。
溶液中铁元素的质量________(填“<”、“=”或“>”)废液中铁元素的质量。
④制备硫酸铜溶液可将铜粉与稀硫酸混合并通入氧气,其反应原理为:2Cu+O2+2H2SO4=2CuSO4+2H2O。现将3.2g铜粉与76g硫酸溶液混合并通入适量氧气,反应恰好完成,则硫酸铜溶液中溶质的质量分数为________(结果精确到0.1%)。
【答案】过滤 ![]() 置换 > 10.0%
置换 > 10.0%
【解析】
①中的操作将固体与溶液进行了分离,所以此操作是过滤,故填:过滤;
②中的反应只有过量的稀硫酸与铁的反应,生成硫酸亚铁和氢气,此反应是单质和化合物生成单质和化合物,所以是置换反应,故填:![]() ;置换;
;置换;
③由于开始向溶液中加入的物质A是铁,所以在不考虑过程中铁元素的损耗的情况下,加入的铁也会变成硫酸亚铁中的铁元素,最终得到的FeSO4溶液中铁元素的质量大于废液中铁元素的质量,故填:>;
④设生成的硫酸铜的质量为x
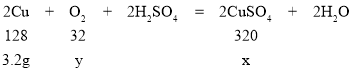
![]()
x=8g,y=0.8g
所以硫酸铜溶液的溶质质量分数为:![]() ×100%=10.0%,故填:10.0%。
×100%=10.0%,故填:10.0%。

练习册系列答案
相关题目