题目内容
【题目】镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
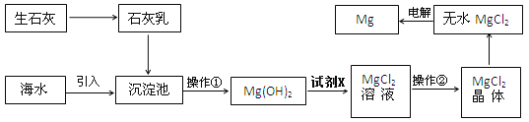
提示:①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是 ___________
(2)试剂X的名称_____________
(3)用氯化镁电解生产金属镁的化学方程式为:___________________
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
(初步探究)出现灰白色沉淀是否为偶然现象
(实验Ⅰ)向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
实验组别 | A | B | C | D |
镁带长度 | 1cm | 3cm | 3cm | 4cm |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
(实验结论)并非偶然,据表分析,________________是实验出现“异常”的主要因素;
(再次探究)该沉淀的成分
(猜想假设)猜想1:Mg;猜想2:MgCl2
(实验Ⅱ)
序号 | 实验操作 | 实验现象 | 实验结论 |
① | 取1g样品,加入足量________,振荡 | 未见气泡 | 猜想1错误 |
② | 取1g样品,加入5mL蒸馏水,振荡 | 沉淀未见溶解 | 猜想2错误 |
③ | 取1gMgCl2固体,加5mL蒸馏水,振荡 | 固体全部溶解 |
(交流讨论)
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2 _________________________;
(2)从实验设计的角度讲,实验③的作用是_______________;
(深入探究)该沉淀的物质的组成
(查阅资料)
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClxnH2O,它受热分解可以产生氧化镁,氯化氢和水;
(实验Ⅲ)
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;
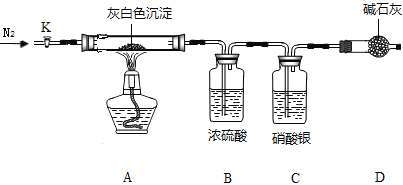
(问题讨论)
(1)反应停止后,应继续通入氮气一段时间,目的_______________________________;
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =______________;(写出计算步骤)
(3)若该沉淀Mgx(OH)yClxnH2O中,n=5,则x、y、z的比值为____________。
【答案】过滤 盐酸 MgCl2![]() Mg+Cl2↑ 氧化镁熔点高,熔融时耗费大量的能量而增加成本 镁带长度 盐酸 在溶液中饱和而析出 对比 使反应生成的气体全部被后续装置吸收 5:1(详见解析) 10:18:2
Mg+Cl2↑ 氧化镁熔点高,熔融时耗费大量的能量而增加成本 镁带长度 盐酸 在溶液中饱和而析出 对比 使反应生成的气体全部被后续装置吸收 5:1(详见解析) 10:18:2
【解析】
一、
(1)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法。操作①的名称是过滤;
(2)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,试剂X的名称盐酸;
(3)氯化镁电解生成金属镁和氯气,反应的化学方程式为:MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(4)根据“MgO的熔点为2852℃,无水MgCl2的熔点为714℃”可知,工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是氧化镁熔点高,熔融时耗费大量的能量而增加成本;
二、
实验结论:根据表各提供的信息可以看出,镁带长短是实验出现“异常”的主要因素;
实验Ⅱ:
镁与盐酸反应生成氯化镁和氢气。若猜想1错误,说明加入的酸不与样品反应产生,实验室①可以加入足量的稀盐酸;
交流讨论:
(1)作出猜想2的依据是他认为生成物MgCl2 在溶液中饱和而析出;
(2)实验③是检验1g氯化镁在5mL的水中是否完全溶解,其的作用是进行实验对比;
问题讨论:
(1)浓硫酸能吸水,硝酸银溶液能吸收氯化氢气体,故反应停止后,应继续通入N2一段时间,目的是使反应生成的气体全部被后续装置吸收;
(2)根据题中的“查阅资料”可知,碱式氯化镁受热分解可以产生氧化镁,氯化氢和水。硬质玻璃管中剩余固体质量为4.00g,该固体为氧化镁,镁元素的质量为:![]() ;装置B的质量增加了2.34g,是反应生成的水质量;根据质量守恒定律可知,C装置增加的质量=7.07g-4.00g-2.34g=0.73g,是反应生成氯化氢的质量,氯元素的质量=
;装置B的质量增加了2.34g,是反应生成的水质量;根据质量守恒定律可知,C装置增加的质量=7.07g-4.00g-2.34g=0.73g,是反应生成氯化氢的质量,氯元素的质量=![]() ,该沉淀中,镁、氯的离子个数比n(Mg2+):n(Cl-)=
,该沉淀中,镁、氯的离子个数比n(Mg2+):n(Cl-)=![]() ;
;
(3)生成物中氧化镁、氯化氢和水分子的个数比为:![]() ,该反应的化学方程式为:Mgx(OH)yClznH2 O
,该反应的化学方程式为:Mgx(OH)yClznH2 O![]() 10MgO+2HCl↑+13H2O。若沉淀Mgx(OH)yClznH2O中,n=5,氢原子的总数为28,故y=18,z=2,x=10则x、y、z的数值依次为10、18、2。
10MgO+2HCl↑+13H2O。若沉淀Mgx(OH)yClznH2O中,n=5,氢原子的总数为28,故y=18,z=2,x=10则x、y、z的数值依次为10、18、2。

【题目】善于归纳知识,有利于提高学习能力。下列知识整理的内容不完全正确的一组是( )
A.化学反应基本类型 | B.化学与生活 |
①化合反应C+O2 ②分解反应H2CO3=H2O+CO2↑ ③置换反应C+2CuO | ①人体缺乏碘元素﹣﹣导致甲状腺肿大 ②鉴别羊毛和合成纤维﹣﹣点燃后闻气味 ③用洗洁精除去餐具油污﹣﹣利用乳化作用 |
C.化学实验数据记录 | D.化学中常见的“三” |
①用托盘天平称取7.8g铁粉 ②用50mL量筒量取47.25mL水 ③用pH试纸测得苹果汁的pH为3.2 | ①煤、石油、天然气﹣﹣三大化石燃料 ②塑料、合成纤维、合成橡胶﹣﹣三大合成材料 ③三种常见干燥剂﹣﹣浓硫酸、氢氧化钠、氧化钙 |
A. AB. BC. CD. D