题目内容
【题目】化学与生活、生产关系密切.请回答下列问题:

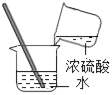
①如图为某抗酸药的实物图.该图标示的物质中,含有的金属元素是______(写出一种即可).
②沾染了油污的衣物用洗洁精就可以洗干净,这是利用了洗洁精的______作用.
③生产加碘盐通常是在食盐中加入碘酸钾(KIO3),碘酸钾中碘元素的化合价为______价.
④某种抗酸药的主要成分是三硅酸镁(Mg2Si3O8),能与盐酸发生复分解反应,则反应后产物中含镁的化合物是______(写化学式)
【答案】Al 乳化 +5 MgCl2
【解析】
(1) 塑料属于有机合成材料,铝箔中含有金属元素铝,其符号为:Al;
(2)洗洁精具有乳化作用,所以能洗涤油污;
(3)钾元素显+1价,氧元素显-2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价;
(4)由于三硅酸镁是和稀盐酸发生的反应是复分解反应,因此生成的盐应该是氯化物,即生成的含镁的化合物应是氯化镁,故答案为:MgCl2。

【题目】镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
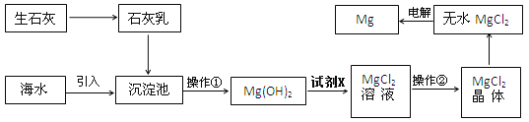
提示:①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是 ___________
(2)试剂X的名称_____________
(3)用氯化镁电解生产金属镁的化学方程式为:___________________
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
(初步探究)出现灰白色沉淀是否为偶然现象
(实验Ⅰ)向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
实验组别 | A | B | C | D |
镁带长度 | 1cm | 3cm | 3cm | 4cm |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
(实验结论)并非偶然,据表分析,________________是实验出现“异常”的主要因素;
(再次探究)该沉淀的成分
(猜想假设)猜想1:Mg;猜想2:MgCl2
(实验Ⅱ)
序号 | 实验操作 | 实验现象 | 实验结论 |
① | 取1g样品,加入足量________,振荡 | 未见气泡 | 猜想1错误 |
② | 取1g样品,加入5mL蒸馏水,振荡 | 沉淀未见溶解 | 猜想2错误 |
③ | 取1gMgCl2固体,加5mL蒸馏水,振荡 | 固体全部溶解 |
(交流讨论)
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2 _________________________;
(2)从实验设计的角度讲,实验③的作用是_______________;
(深入探究)该沉淀的物质的组成
(查阅资料)
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClxnH2O,它受热分解可以产生氧化镁,氯化氢和水;
(实验Ⅲ)
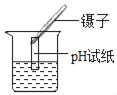
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;
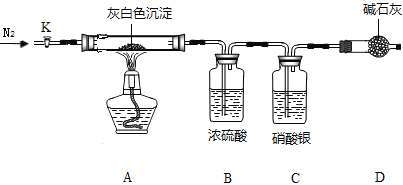
(问题讨论)
(1)反应停止后,应继续通入氮气一段时间,目的_______________________________;
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =______________;(写出计算步骤)
(3)若该沉淀Mgx(OH)yClxnH2O中,n=5,则x、y、z的比值为____________。