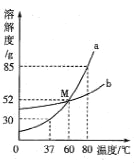
题目内容
【题目】善于归纳知识,有利于提高学习能力。下列知识整理的内容不完全正确的一组是( )
A.化学反应基本类型 | B.化学与生活 |
①化合反应C+O2 ②分解反应H2CO3=H2O+CO2↑ ③置换反应C+2CuO | ①人体缺乏碘元素﹣﹣导致甲状腺肿大 ②鉴别羊毛和合成纤维﹣﹣点燃后闻气味 ③用洗洁精除去餐具油污﹣﹣利用乳化作用 |
C.化学实验数据记录 | D.化学中常见的“三” |
①用托盘天平称取7.8g铁粉 ②用50mL量筒量取47.25mL水 ③用pH试纸测得苹果汁的pH为3.2 | ①煤、石油、天然气﹣﹣三大化石燃料 ②塑料、合成纤维、合成橡胶﹣﹣三大合成材料 ③三种常见干燥剂﹣﹣浓硫酸、氢氧化钠、氧化钙 |
A. AB. BC. CD. D
【答案】C
【解析】
A、反应①是由两种物质生成都一种物质的反应,属于化合反应;反应②是由一种物质生成两种物质的反应,属于分解反应;③是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应,故A正确;
B、①人体缺乏碘元素会导致甲状腺肿大;②鉴别羊毛和合成纤维,可点燃后闻气味,产生烧焦羽毛气味的是羊毛,产生刺激性气味的是合成纤维;③用洗洁精具有乳化作用,所以可除去餐具油污,故B正确;
C、①托盘天平可准确到0.1g,用托盘天平能称取7.8g铁粉;②量筒只能精确到0.1mL,用50mL量筒不能量取47.25 mL水,③pH试纸测出的值是整数,所以用pH试纸测得苹果汁的pH不可能为3.2,故C错误;
D、①煤、石油、天然气是三大化石燃料;②塑料、合成纤维、合成橡胶是三大合成材料;③浓硫酸、氢氧化钠、氧化钙是三种常见的干燥剂,故D正确。故选C。

【题目】我省稀土资源丰富,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染农业用水和生活用水。某研究性学习小组对此展开了研究。
(查阅资料)a.草酸的化学式为H2C2O4,草酸是一种无色透明的晶体,对人体有害,具有酸的通性:如能与碳酸盐反应产生二氧化碳,能与活泼金属反应等。例如:H2C2O4+Na2CO3=Na2C2O4+CO2↑+H2O;
b.一氧化碳遇到浸有磷钼酸溶液的氯化钯黄色试纸立即变蓝,而CO2遇试纸不变色。回答下列问题:
(1)写出金属铁与草酸反应的化学方程式_______;
(2)硫酸铵在农业上可作化肥使用,在施肥时不能将它与_______混合使用;
(设计方案)草酸加热能分解生成水和气体,研究性学习小组的同学对受热分解生成的气体作如图所示的探究:
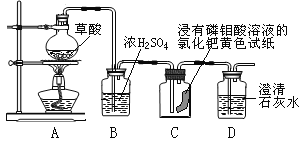
(实验探究)该研究性学习小组同学通过观察实验中的现象,验证猜想。
(现象与结论)请你帮助他们完成报告:
步骤 | 现象 | 结论 |
点燃酒精灯加热,观察现象 | 装置C中:______ 装置D中:_______ | 产生的气体中有CO和CO2 |
(讨论与反思)(1)实验中依据B装置中溶液质量增大,可判断草酸分解生成了 _______;
(2)根据结论,从环保的角度考虑,装置中存在不足之处,改进的方法是_______。
【题目】镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
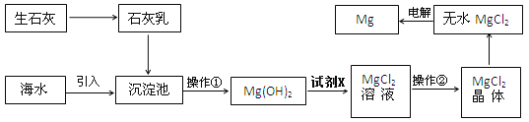
提示:①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是 ___________
(2)试剂X的名称_____________
(3)用氯化镁电解生产金属镁的化学方程式为:___________________
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
(初步探究)出现灰白色沉淀是否为偶然现象
(实验Ⅰ)向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
实验组别 | A | B | C | D |
镁带长度 | 1cm | 3cm | 3cm | 4cm |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
(实验结论)并非偶然,据表分析,________________是实验出现“异常”的主要因素;
(再次探究)该沉淀的成分
(猜想假设)猜想1:Mg;猜想2:MgCl2
(实验Ⅱ)
序号 | 实验操作 | 实验现象 | 实验结论 |
① | 取1g样品,加入足量________,振荡 | 未见气泡 | 猜想1错误 |
② | 取1g样品,加入5mL蒸馏水,振荡 | 沉淀未见溶解 | 猜想2错误 |
③ | 取1gMgCl2固体,加5mL蒸馏水,振荡 | 固体全部溶解 |
(交流讨论)
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2 _________________________;
(2)从实验设计的角度讲,实验③的作用是_______________;
(深入探究)该沉淀的物质的组成
(查阅资料)
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClxnH2O,它受热分解可以产生氧化镁,氯化氢和水;
(实验Ⅲ)
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;
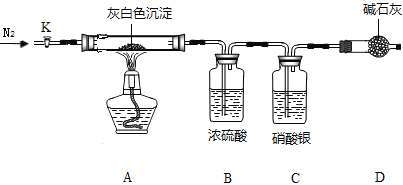
(问题讨论)
(1)反应停止后,应继续通入氮气一段时间,目的_______________________________;
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =______________;(写出计算步骤)
(3)若该沉淀Mgx(OH)yClxnH2O中,n=5,则x、y、z的比值为____________。
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()