题目内容
黄铜是由铜、锌组成的合金.为测定某种黄铜中锌的含量,取43.4g这种黄铜和质量分数为19.6%的硫酸溶液100g恰好完全反应,将未反应的铜过滤后得到112.6g溶液.
试计算(计算结果保留1位小数)
(1)合金中锌的质量分数;
(2)反应后所得溶液中溶质的质量分数.
(1)30% (2)28.6%
解析试题分析:(1)由题意可以知道反应消耗的硫酸中溶质的质量为:100g×19.6%=19.6g.
设合金中锌的质量为x,硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 98 161
x 19.6g y 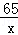 =
=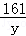 =
=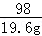
解得:x="13g" y=32.2g
所以合金中锌的质量分数为: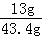 ×100%=30%
×100%=30%
(2)反应后所得溶液中溶质的质量分数为: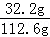 ×100%=28.6%
×100%=28.6%
答:(1)合金中锌的质量分数为30%;
(2)反应后所得溶液中溶质的质量分数为28.6%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,结合数学图象解答,难度较大.注意:注意标明气体;计算要细心、准确.

练习册系列答案
相关题目
实验室制取二氧化碳应选用的一组仪器是( )。
| A.长颈漏斗、广口瓶、导管、酒精灯 |
| B.长颈漏斗、广口瓶、导管、集气瓶 |
| C.长颈漏斗、广口瓶、导管、水槽 |
| D.大试管、导管、量筒 |