题目内容
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,某化学兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,并用热重法(TG)确定其分解后所得固体产物的组成,探究过程如下:
(查阅资料)
(1)草酸亚铁晶体受热失去结晶水。
(2)草酸亚铁晶体热分解的气体产物是H2O、CO、CO2。
(3)白色的无水CuSO4遇水蒸气会变成蓝色。
(4)浓硫酸具有吸水干燥的性质。
(5)氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水。
(实验设计)
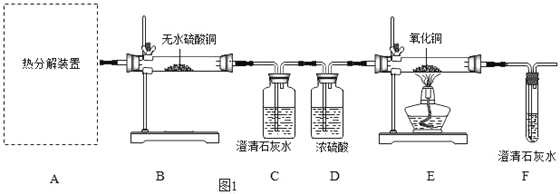
(1)从环保角度考虑,该套实验装置的明显缺陷是_____如何改进_____。
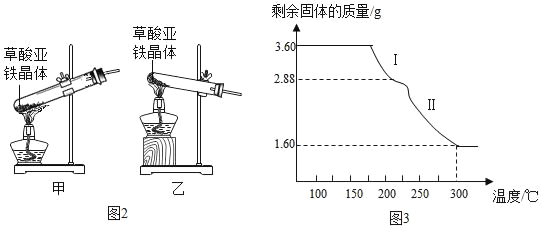
(2)可选择以下实验装置中的_____(选填“甲”或“乙”)作为虚线中的“热分解装置”。
(问题讨论)
(3)实验过程中观察到:B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊的反应方程式_____(填化学方程式),E中_____(填实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO2、CO。
(4)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是_____。
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有CO,则需在C和D装置之间增加盛有足量的浓氢氧化钠溶液的洗气瓶,其作用是_____。
(数据分析)
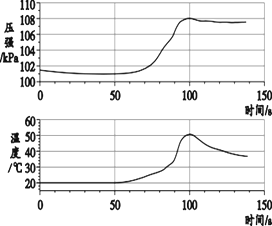
(6)称取3.60g草酸亚铁晶体(FeC2O42H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图3所示,请分析该图回答下列问题:
①过程Ⅰ发生反应的化学方程式:为_____。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式或名称_____。
请写出计算过程:
【答案】没有处理尾气装置 在F装置右边导管口处点燃尾气,或收集尾气 乙 Ca(OH)2+CO2═CaCO3↓+H2O 黑色固体变红色 排出装置中的空气,防止发生爆炸 吸收二氧化碳气体 FeC2O42H2O![]() FeC2O4+2H2O Fe2O3或氧化铁
FeC2O4+2H2O Fe2O3或氧化铁
【解析】
(1)一氧化碳是空气污染物,从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气装置,改进方法:在F装置右边导管口处点燃尾气,或收集尾气;
(2)加热固体时,试管口略向下倾斜能够防止水蒸气冷凝回流炸裂试管,故选装置乙;
(3)实验过程中观察到:B中白色无水CuSO4变成蓝色,说明草酸亚铁晶体分解生成了水,C中澄清石灰水变浑浊,是因为二氧化碳和氢氧化钙反应生成白色沉淀碳酸钙和水,反应的反应方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
E中黑色固体变红色,说明草酸亚铁晶体分解生成了一氧化碳,一氧化碳和氧化铜反应生成了铜和二氧化碳;
(4)先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是排出装置中的空气,防止一氧化碳和空气混合加热时发生爆炸;
(5)足量的浓氢氧化钠溶液能够充分吸收草酸晶体分解生成的二氧化碳;
(6)①过程Ⅰ中,草酸亚铁晶体分解生成草酸亚铁和水,发生反应的化学方程式为:为 FeC2O42H2O![]() FeC2O4+2H2O。
FeC2O4+2H2O。
②草酸亚铁晶体中的铁元素质量为:3.60g×![]() ×100%=1.12g,
×100%=1.12g,
氧化物中氧元素的质量为:1.60g﹣1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3。