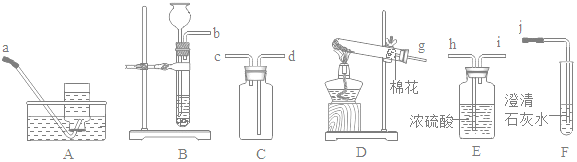
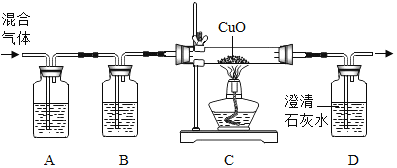
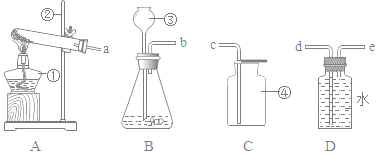
题目内容
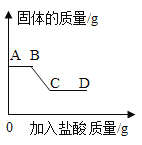
【题目】小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金作出下列判断,其中不合理的是
A. “立即出现红色固体”是由于很快发生了如下转化:CuO![]() CuSO4
CuSO4![]() Cu
Cu
B. “产生大量无色气泡”是由于发生了如下反应:Fe+H2SO4=FeSO4+H2↑
C. 该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应
D. 在不同浓度的硫酸铜和稀疏酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应
【答案】D
【解析】A、“立即出现红色固体”是由于很快发生了如下转化:CuO![]() CuSO4
CuSO4![]() Cu,铜是红色,故A正确;B、“产生大量无色气泡”是由于发生了如下反应:Fe+H2SO4=FeSO4+H2↑,故B正确;C、该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应,故C正确;D、在不同浓度的硫酸铜和稀疏酸的混合溶液中投入铁粉,不一定都是硫酸铜先跟铁粉反应,故D错误。
Cu,铜是红色,故A正确;B、“产生大量无色气泡”是由于发生了如下反应:Fe+H2SO4=FeSO4+H2↑,故B正确;C、该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应,故C正确;D、在不同浓度的硫酸铜和稀疏酸的混合溶液中投入铁粉,不一定都是硫酸铜先跟铁粉反应,故D错误。

练习册系列答案
相关题目