题目内容
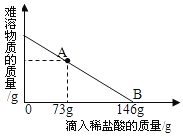
【题目】在一烧杯中盛有100g BaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示。
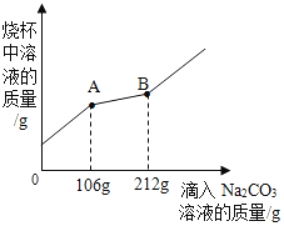
(1)在实验过程中,可以先后看到的明显实验现象是_____。
(2)求原溶液中BaCl2的质量分数为多少?_________
(3)当滴入Na2CO3溶液至图中B点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到0.1%)_________
【答案】先有气体放出,后有白色沉淀生成 7.3% 8.1%
【解析】
(1)向盛有BaCl2和HCl的混合溶液中滴加Na2CO3溶液时,碳酸钠先与盐酸反应产生二氧化碳,当盐酸反应完后,再与氯化钡反应产生碳酸钡沉淀;
(2)开始时是生成气体的,由于加入的是碳酸钠溶液,而生成的是二氧化碳气体,两者的质量明显是增加多,减少的少,所以曲线明显上扬。当不再生成二氧化碳时,就生成碳酸钡,由于碳酸钡的质量要多于碳酸钠的,所以导致溶液的质量增加减缓。从图中曲线可看出,当滴入碳酸钠106g时,盐酸完全反应,据此可根据滴入碳酸钠质量计算消耗HCl的质量;
(3)从图中曲线可看出,开始滴入106克的碳酸钠与盐酸反应,106克~212克之间滴入碳酸钠与氯化钡反应;即与氯化钡反应的碳酸钠质量为212克-106克;由化学方程式知,碳酸钠和盐酸、氯化钡反应后溶液中溶质均为氯化钠,可根据化学方程式中参加反应的碳酸钠质量计算生成的氯化钠质量和碳酸钡沉淀质量,再根据质量守恒定律,参加反应的物质总质量等于生成的物质总质量,最后所得不饱和溶液的质量等于l00gBaCl2和HCl的混合溶液,加上滴入的212gNa2CO3溶液,减去生成的气体和沉淀的质量,即可计算所得不饱和溶液中溶质质量分数。
解:(1)碳酸钠和盐酸反应产生二氧化碳,有气体放出,与氯化钡反应产生碳酸钡,即有白色沉淀产生;
(2)设原溶液中BaCl2的质量为x,则:
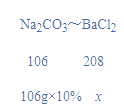
![]()
x=20.8g,
原溶液中BaCl2的质量分数为:![]() ×100%=20.8%;
×100%=20.8%;
(3)设实验过程中产生氯化钠质量为y,产生碳酸钡质量为z,则:本关系是指整个过程的,不考虑是碳酸钠与盐酸还是和氯化钡反应,最终对应的钠都在氯化钠中;

![]()
y=23.4g,
后期的碳酸钠中碳酸根转化为碳酸钡沉淀,所以对应的碳酸钠是106g溶液之后的部分:

![]()
z=19.7g,
所得NaCl溶液的质量分数为:![]() ×100%=8.1%;
×100%=8.1%;
答:(1)在实验过程中,可以先后看到的明显实验现象是:先有气体放出,后有白色沉淀生成;
(2)原溶液中BaCl2的质量分数为20.8%;
(3)所得不饱和溶液中溶质质量分数是8.1%。

 百年学典课时学练测系列答案
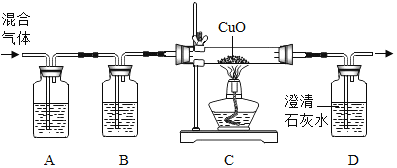
百年学典课时学练测系列答案【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水的体积变化得出O2的体积 | 集气瓶中的水:冷却溅落的熔融物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,便于观察O2何时收集满 |
A. AB. BC. CD. D