题目内容
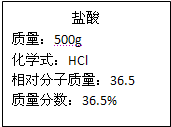
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
(1)为了证明该瓶盐酸显酸性,你可以采取的做法是______.(简单描述即可)
(2)取出200g该浓盐酸,稀释成18.25%的稀盐酸,需要加入水的质量为______g.
(3)现用刚配好的100g 18.25%的盐酸与足量的锌粒完全反应,理论上可以生成氢气的质量是多少?(反应化学方程式:Zn+2HCl=ZnCl2+H2↑)
(1)为了证明该瓶盐酸显酸性,你可以采取的做法是______.(简单描述即可)
(2)取出200g该浓盐酸,稀释成18.25%的稀盐酸,需要加入水的质量为______g.
(3)现用刚配好的100g 18.25%的盐酸与足量的锌粒完全反应,理论上可以生成氢气的质量是多少?(反应化学方程式:Zn+2HCl=ZnCl2+H2↑)

(1)紫色石蕊试液遇酸变红,蓝色石蕊试纸遇酸变红,pH试纸可测出溶液的pH值也可得溶液是否是酸.故答案为:取样品少许,滴加紫色石蕊试液;
(2)200g该浓盐酸中溶质的质量:200g×36.5%═73g
稀释后稀盐酸的质量:73g÷18.25%=400g
需加入水的质量:400g-200g=200g
故答案为:200g;
(3)设理论上可以生成氢气的质量是x.
Zn+2HCl=ZnCl2 +H2↑
73 2
100g×18.25%x
═
解得x=0.5g
答:理论上可以生成氢气的质量是0.5g.
(2)200g该浓盐酸中溶质的质量:200g×36.5%═73g
稀释后稀盐酸的质量:73g÷18.25%=400g
需加入水的质量:400g-200g=200g
故答案为:200g;
(3)设理论上可以生成氢气的质量是x.
Zn+2HCl=ZnCl2 +H2↑
73 2
100g×18.25%x
| 73 |
| 100g×18.25% |
| 2 |
| x |
解得x=0.5g
答:理论上可以生成氢气的质量是0.5g.

练习册系列答案
相关题目