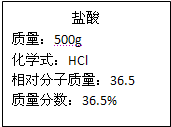
题目内容
将一块质量为5.8g的铁合金(成分为铁和碳)放入烧杯中,再向烧杯中加入94.6g稀H2SO4,恰好与铁合金中的铁完全反应(碳不溶于稀H2SO4),所得氢气的质量为0.2g.已知含碳量高于2%的铁合金为生铁,含碳量低于2%的铁合金为钢,试根据计算回答:
(1)该铁合金是生铁还是钢?
(2)反应后所得溶液中溶质的质量分数是多少?
(1)该铁合金是生铁还是钢?
(2)反应后所得溶液中溶质的质量分数是多少?
设铁合金中铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.2g
=
=
x=5.6g y=15.2g
(1)铁合金的含碳量为
×100%≈3.4%>2%
故该铁合金属于生铁.
(2)反应后溶液中溶质的质量分数为
×100%=15.2%
答:(1)该合金是生铁;
(2)反应后所得溶液中溶质的质量分数是15.2%.
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.2g
| 56 |
| x |
| 152 |
| y |
| 2 |
| 0.2g |
x=5.6g y=15.2g
(1)铁合金的含碳量为
| 5.8g-5.6g |
| 5.8g |
故该铁合金属于生铁.
(2)反应后溶液中溶质的质量分数为
| 15.2g |
| 5.6g+94.6g-0.2g |
答:(1)该合金是生铁;
(2)反应后所得溶液中溶质的质量分数是15.2%.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目

 a)g
a)g