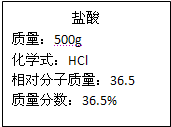
题目内容
某化学兴趣小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析.其实验数据如下表.
根据表中数据,计算:
(1)产生氢气的质量为______克;
(2)生铁样品中铁的质量分数.
根据表中数据,计算:
| 实验步骤 | 相关数据 |
| 1.称取生铁样品放入烧杯中 | 16g |
| 2.加入足量15%的盐酸 | 200.0g |
| 3.称取反应后烧杯中物质总质量 | 215.6g |
(2)生铁样品中铁的质量分数.
(1)产生氢气的质量:(200g+16g)-215.6g=0.4g.
故答案为:0.4g;
(2)解设生铁中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
=
解得:x=11.2g
生铁样品中铁的质量分数:
×100%=70%
答:生铁样品中铁的质量分数为70%.
故答案为:0.4g;
(2)解设生铁中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
| 56 |
| 2 |
| x |
| 0.4g |
解得:x=11.2g
生铁样品中铁的质量分数:
| 11.2g |
| 16g |
答:生铁样品中铁的质量分数为70%.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目