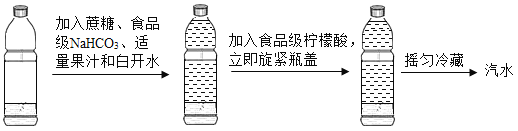
题目内容
【题目】从海水得到的粗盐往往含有可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.实验室模拟工业粗盐提纯的流程如图,请回答: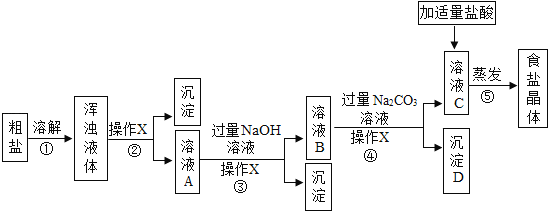
(1)步骤①和②的目的是________,步骤③的主要目的是________.
(2)操作X的名称是________,该操作中用到的玻璃仪器有烧杯、玻璃棒和________.向溶液C中加入适量盐酸,控制盐酸用量的操作方法是________.
(3)本实验从滤液C得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度数据分析原因________.
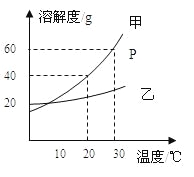
(4)下表提供了两种物质的溶解度数据,读取信息后回答:
温度℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
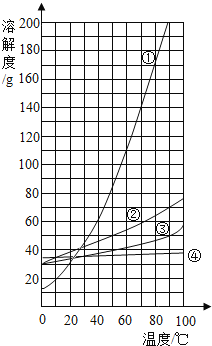
看图判断,氯化钠的溶解度曲线是上图________(填数字编号),40℃时,将60g硝酸钾溶于100g水中,降温至10℃时可析出硝酸钾晶体________ g.
【答案】除去不溶性固体杂质 除去氯化镁 过滤 漏斗 用胶头滴管逐滴加入 氯化钠的溶解度受温度影响变化不大 ④ 39.1g
【解析】
氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,由氯化钠和硝酸钾溶解度数据表可知,氯化钠的溶解度受温度影响变化不大,硝酸钾的溶解度随温度的升高而增大。
(1)步骤①和②是溶解和过滤,目的是除去不溶性固体杂质,步骤③加入的是氢氧化钠溶液,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,故主要目的是除去氯化镁。
(2)操作X将固体和液体分离,故名称是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗,向溶液C中加入适量盐酸,控制盐酸用量的操作方法是用胶头滴管逐滴加入。
(3)从滤液C得到精盐,采用的是蒸发溶剂的方法是因为氯化钠的溶解度受温度影响变化不大。
(4)氯化钠的溶解度受温度影响变化不大,故溶解度曲线是上图中的④;40℃时,硝酸钾的溶解度为63.9g,将60g硝酸钾溶于100g水中,完全溶解,降温至10℃时,其溶解度为20.9g,故可析出硝酸钾晶体的质量为![]() 。
。

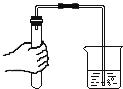
【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。
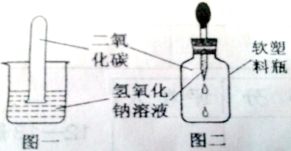
【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
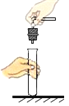
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
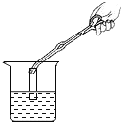
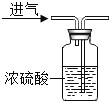
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。