题目内容
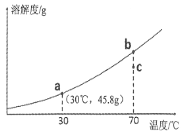
【题目】某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示.下列说法正确的是( )
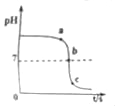
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
【答案】 D
【解析】A、c点时溶液的pH小于7,显酸性,故选项说法错误.B、a点时溶液的pH大于7,显碱性,图中a点所示溶液中,含有的溶质是K2SO4和KOH,故选项说法错误.C、由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把硫酸滴加到氢氧化钾溶液中,故选项说法错误.D、由b点到c点的变化过程中,是恰好完全反应后继续滴加稀硫酸,变化过程中没有发生化学反应,故选项说法正确.故选:D.

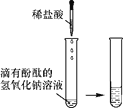
【题目】某化学兴趣小组的同学向氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成________ | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为__________ |
乙 |
| U形玻璃管中________边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用________测定氢氧化钠溶液的pH;向其中滴加足量的稀盐酸后,再测定溶液的pH | 最后溶液的pH________(填“≥7”“≤7”或“不变”) | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是________,理由是______________________________。