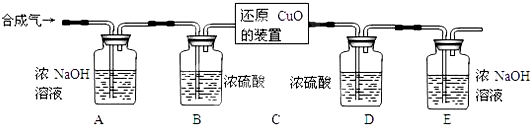
题目内容
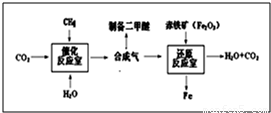
一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.(1)二甲醚与酒精(C2H5OH)的化学式组成 (选填“相同”或“不相同”).二甲醚在空气中完全燃烧生成二氧化碳和水得化学反应方程式为 .若在二甲醚火焰上放一白瓷板,可观察到白瓷板上有 .
(2)还原反应室内发生的化学反应(赤铁矿中杂质不参加反应)共有 个,若还原反应室利用甲烷完全燃烧维持高温,则还原反应室所得产品 (选填“属于”或“不属于”)生铁.
(3)写出催化反应室中发生的化学反应方程式 (任写一个).上述生产过程中,可参与循环的物质有 、 .
(4)绿色化学的特点之一是“零排放”,即反应物原子全部进入到需要的产品中.由合成气制备二甲醚的反应 (选填“符合”、或“不符合”)这一特点.
(5)上述生产过程中所得合成气中CO和H2的质量比不可能是 .
A、14:3 B、7:1 C、14:5 D、28:5.
【答案】分析:(1)比较二甲醚与酒精的化学式的原子的种类及个数;根据二甲醚燃烧的反应写出反应的方程式,根据二甲醚燃烧的产物分析实验的现象;
(2)根据还原反应室内物质的性质分析发生的反应;若还原反应室利用甲烷完全燃烧维持高温,则还原反应室所得产品不含碳;
(3)根据催化反应室中发生的反应写出反应的方程式,根据利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程分析参与循环的物质;
(4)根据生产合成器内的反应分析CO和H2的质量比的范围.
解答:解:(1)由二甲醚与酒精的化学式中原子的种类及个数相同可知,二甲醚与酒精(C2H5OH)的化学式组成相同;二甲醚在空气中完全燃烧生成二氧化碳和水,反应的方程式为:CH3OCH3+3O2 2CO2+3H2O;由于二甲醚燃烧的产物中有水.所以,若在二甲醚火焰上放一白瓷板,可观察到白瓷板上有水珠;
2CO2+3H2O;由于二甲醚燃烧的产物中有水.所以,若在二甲醚火焰上放一白瓷板,可观察到白瓷板上有水珠;
(2)还原反应室内发生的化学反应有氢气、一氧化碳和氧化铁的两个反应.若还原反应室利用甲烷完全燃烧维持高温,则生成的铁中不含有碳,不属于生铁;
(3)在催化反应室中水蒸气与甲烷催化重整得到氢气和一氧化碳,化学反应方程式为:CH4+H2O CO+3H2;由生产过程中可知,可参与循环的物质有CO2、H2O;
CO+3H2;由生产过程中可知,可参与循环的物质有CO2、H2O;
(4)合成气制备二甲醚的反应物中的原子全部转化为生成物中,符合零排放的特点;
(5)由生产过程中发生的反应可知,在CH4+H2O CO+3H2,生成CO和H2的质量比为28:6=14:3;在CO2+CH4
CO+3H2,生成CO和H2的质量比为28:6=14:3;在CO2+CH4 2CO+2H2,生成CO和H2的质量比为56:4=14:1.所以,上述生产过程中所得合成气中CO和H2的质量比在14:1和14:3之间.所以,不可能是AC.
2CO+2H2,生成CO和H2的质量比为56:4=14:1.所以,上述生产过程中所得合成气中CO和H2的质量比在14:1和14:3之间.所以,不可能是AC.
故答为:(1)相同,CH3OCH3+3O2 2CO2+3H2O,水珠;(2)2,不属于;(3)CH4+H2O
2CO2+3H2O,水珠;(2)2,不属于;(3)CH4+H2O CO+3H2,CO2,H2O;(4)符合;(5)AC.
CO+3H2,CO2,H2O;(4)符合;(5)AC.
点评:本题解题的关键是根据题干提供的信息,找出反应物、生成物,写出反应的方程式,再根据方程式进行有关问题的分析与判断.
(2)根据还原反应室内物质的性质分析发生的反应;若还原反应室利用甲烷完全燃烧维持高温,则还原反应室所得产品不含碳;
(3)根据催化反应室中发生的反应写出反应的方程式,根据利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程分析参与循环的物质;
(4)根据生产合成器内的反应分析CO和H2的质量比的范围.
解答:解:(1)由二甲醚与酒精的化学式中原子的种类及个数相同可知,二甲醚与酒精(C2H5OH)的化学式组成相同;二甲醚在空气中完全燃烧生成二氧化碳和水,反应的方程式为:CH3OCH3+3O2
 2CO2+3H2O;由于二甲醚燃烧的产物中有水.所以,若在二甲醚火焰上放一白瓷板,可观察到白瓷板上有水珠;
2CO2+3H2O;由于二甲醚燃烧的产物中有水.所以,若在二甲醚火焰上放一白瓷板,可观察到白瓷板上有水珠;(2)还原反应室内发生的化学反应有氢气、一氧化碳和氧化铁的两个反应.若还原反应室利用甲烷完全燃烧维持高温,则生成的铁中不含有碳,不属于生铁;
(3)在催化反应室中水蒸气与甲烷催化重整得到氢气和一氧化碳,化学反应方程式为:CH4+H2O
 CO+3H2;由生产过程中可知,可参与循环的物质有CO2、H2O;
CO+3H2;由生产过程中可知,可参与循环的物质有CO2、H2O;(4)合成气制备二甲醚的反应物中的原子全部转化为生成物中,符合零排放的特点;
(5)由生产过程中发生的反应可知,在CH4+H2O
 CO+3H2,生成CO和H2的质量比为28:6=14:3;在CO2+CH4
CO+3H2,生成CO和H2的质量比为28:6=14:3;在CO2+CH4 2CO+2H2,生成CO和H2的质量比为56:4=14:1.所以,上述生产过程中所得合成气中CO和H2的质量比在14:1和14:3之间.所以,不可能是AC.
2CO+2H2,生成CO和H2的质量比为56:4=14:1.所以,上述生产过程中所得合成气中CO和H2的质量比在14:1和14:3之间.所以,不可能是AC.故答为:(1)相同,CH3OCH3+3O2
 2CO2+3H2O,水珠;(2)2,不属于;(3)CH4+H2O
2CO2+3H2O,水珠;(2)2,不属于;(3)CH4+H2O CO+3H2,CO2,H2O;(4)符合;(5)AC.
CO+3H2,CO2,H2O;(4)符合;(5)AC.点评:本题解题的关键是根据题干提供的信息,找出反应物、生成物,写出反应的方程式,再根据方程式进行有关问题的分析与判断.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有:
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有: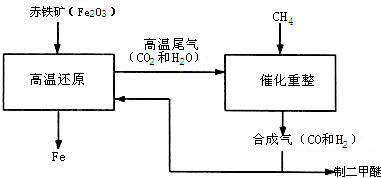
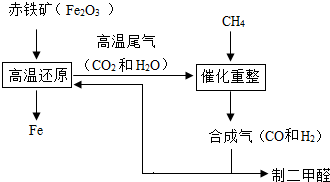
 (2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.
(2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程. (1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为
(1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为