题目内容
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.(1)煤的气化主要反应有:
①2C+O2═2CO ②C+H2O═CO+H2 ③CO+H2O═CO2+H2
上述反应属于化合反应的是
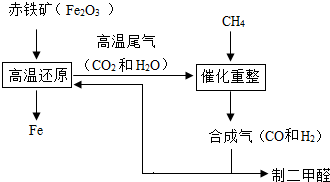
(2)合成气可通过天然气的重整得到,如CH4+H2O═CO+3H2 合成气可制二甲醚,二甲醚被称为21世纪的新型燃料.合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如下:
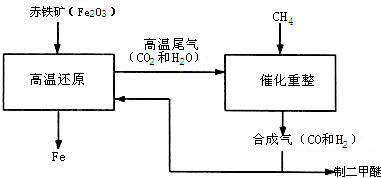
①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的.用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:
②合成气在冶炼铁的生产过程中所起的作用是
(3)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化).
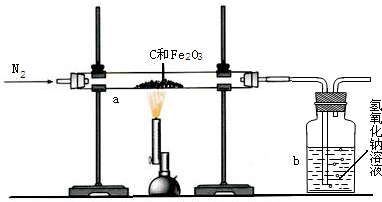
①实验中持续通入干燥的氮气.加热前缓缓通入一段时间,其作用是
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?
③如果氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的质量变化测定出氧化铁的质量分数将
Ⅱ.乙同学取矿石样品10g,加入足量稀盐酸,完全反应后,共用去稀盐酸109.5g过滤得到滤渣2g(假设杂质既不溶于水也不与酸发生反应).请你和乙同学-起计算赤铁矿石中氧化铁的质量分数和反应后溶液中溶质的质量分数.(请写出计算过程).
分析:可以根据物质的性质和用途及其炼铁原理等方面进行分析、判断,从而得出正确的结论.
解答:解:(1)化合反应是两种或两种以上物质反应后生成另一种物质的反应故答案为:①、①②③
(2)①根据反应物生成物和质量守恒书写化学方程式.故答案为:2CO+4H2═CH3OCH3+H2O
②合成气为CO和H2 故答案为:做还原剂
(3)①加热前缓缓通入氮气为了赶走空气故答案为:排净装置内的空气
②不需要因为实验中要持续通入氮气③氢氧化钠吸收了生成的二氧化碳但不能吸收一氧化碳;同时气体放出时会带走部分水蒸气;故答案为:偏小、一氧化碳的生成和气体带走水蒸气
解:赤铁矿石中氧化铁的质量分数为:
×100%=80%
设反应生成氯化铁的质量为x
Fe2O3+6HCl═2FeCl3+3H2O
160 325
8g x
=
,x═16.25g
×100%═13.8%
答:赤铁矿石中氧化铁的质量分数为80%,反应后溶液中溶质的质量分数约为13.8%
(2)①根据反应物生成物和质量守恒书写化学方程式.故答案为:2CO+4H2═CH3OCH3+H2O
②合成气为CO和H2 故答案为:做还原剂
(3)①加热前缓缓通入氮气为了赶走空气故答案为:排净装置内的空气
②不需要因为实验中要持续通入氮气③氢氧化钠吸收了生成的二氧化碳但不能吸收一氧化碳;同时气体放出时会带走部分水蒸气;故答案为:偏小、一氧化碳的生成和气体带走水蒸气
解:赤铁矿石中氧化铁的质量分数为:
| (10-2)g |
| 10g |
设反应生成氯化铁的质量为x
Fe2O3+6HCl═2FeCl3+3H2O
160 325
8g x
| 160 |
| 8g |
| 325 |
| x |
| 16.25g |
| (109.5+8)g |
答:赤铁矿石中氧化铁的质量分数为80%,反应后溶液中溶质的质量分数约为13.8%
点评:本题主要考查了化学方程式的书写及计算及其高炉炼铁等方面的内容.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有:
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有: (2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.
(2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程. (1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为
(1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为