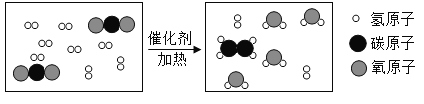
��Ŀ����
����Ŀ���γDZ��ٻƺ��������Ļ�ȫ��֪����ij��ȤС��ͬѧȥ�γ��ιۣ������˲��ִ�����Ʒ�����������������̽����
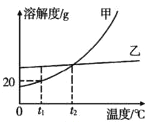
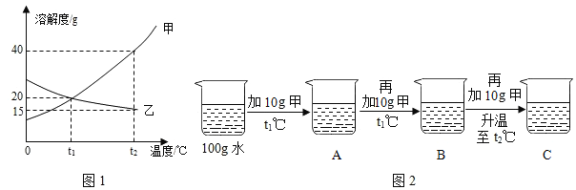
��1���������б����õ���һ��������_____������ţ�
A���в� B����Ͳ C���ձ� D���Թ�
��2����������������_____�����������õ�������������Ϊ_____��
��3�����ᴿ�õ��ġ����Ρ�����100g 6.5%���Ȼ�����Һ������⣬������������ƫС����ԭ�������_____������ţ���
���Ȼ��ƹ��岻�� ������ʱ����������ŷ��� ����ȡˮʱ���Ӷ��� ��װƿʱ����������Һ����
��4���������ϵ�֪�������г���������ɳ�Ȳ����������⣬�����������Ŀ��������ʣ��ٶ�����������ֻ��MgCl2һ�֣���Ϊ�˵õ��ϴ������Ȼ��ƣ�С��ͬѧ�����õġ����Ρ����������´�����
����ɫ�����Ļ�ѧʽΪ_____��
���ڵõ�����Һ�м���������ϡ�����Ŀ����_____��
����ʵ������в�������ģ����յõ���NaCl�����������_____������ڡ�����С�ڡ����ڡ���ԭ������NaCl��������
��5���������㣺��ȡ10�˸þ��ξ�������1��2���������ð�ɫ��������Ϊ0.29�ˣ��þ��Σ��������������ʣ����Ȼ��Ƶ���������Ϊ_____��д����������
���𰸡�A ���� ���裬�������� 1��2 Mg(OH)2 ��ȥ������NaOH ���� 95.25��
��������
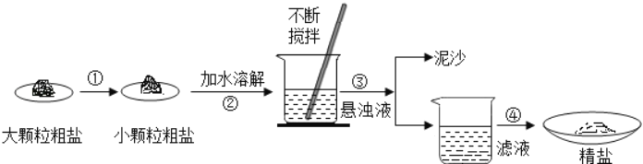
��1��������������Ƴ�С��������ͨ����ĥ�Ϳ���ʵ�֣��õ����������в�������A��
��2�������۽�����Һ�е������Թ�����Һ����뿪�����ܹ����������Թ�����Һ��IJ����ǹ��ˣ�������ˣ�
�����ܰ���Һ�е����ʷ���������ò���ӦΪ�����������в������������ǽ��裬ʹҺ��������ȣ���ֹҺ�ηɽ���������裬�������ȡ�
��3�����Ȼ��ƹ��岻�����������ʣ�ʹ�Ȼ��Ƶ�����ƫС��������Ƶ���Һ������������ƫС��ѡ����ȷ��
�ڳ���ʱ����������ŷ��ˣ�����ɳ�ȡ���Ȼ��Ƶ�����ƫС�����Ƶ���Һ������������ҲƫС��ѡ����ȷ��
����ȡˮʱ���Ӷ�������ȡ��ˮ�����С���������������Ƶ���Һ������������ƫ��ѡ�����
��װƿʱ����������Һ��������ɽ���ƿ�е���Һ�������٣�����Һ�ľ�һ�Կ�֪���˲�����Ӱ����Һ����������������ѡ�������٢ڡ�
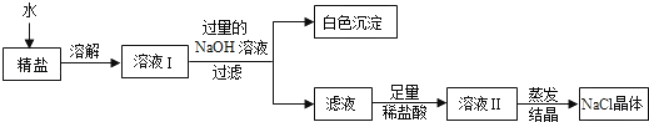
��4������Ʒ�е��Ȼ�þ���������Ʒ�Ӧ�����Ȼ��ƺ�������þ�İ�ɫ����������ɫ����Ϊ������þ���仯ѧʽΪMg(OH)2������Mg(OH)2��
�ڼ���������ϡ��������ǰ��������������Ʒ�Ӧ����������������ȫ��ȥ�������ȥ������NaOH��
�۷�Ӧ�м������������һ�������Ȼ�þ��Ӧ�����Ȼ��ƣ���һ������ϡ���ᷴӦ�������Ȼ��ƣ�ʹ���յõ����Ȼ��Ƶ���������ԭ������NaCl��������������ڡ�
��5���⣺��ԭ�������Ȼ�þ������Ϊx

95:58=x:0.29g
x=0.475g
�������Ȼ��Ƶ���������Ϊ![]() ��100��=95.25��
��100��=95.25��
�𣺾������Ȼ��Ƶ���������Ϊ95.25����

����Ŀ�����ΪԪ�����ڱ���һ���֣����������֢٩�������ʾԪ������������⡣
�� | He | ||||||
�� | �� | Ne | |||||
�� | �� | Ar | |||||
��1��д��һ����Ļ�ѧʽ_____��
��2���ɢ١�������Ԫ����ɣ���Ԫ�آ۳ʩ�1�۵����ʵĻ�ѧʽΪ_____��
��3���û�ѧ�����ʾ��һ�ֲ����Լ��н���Ԫ�صĻ��ϼ�_____��
��4���ɢ١��ۡ�������Ԫ����ɵ�������ʹ��ɫʯ����Һ��Ϊ_____������ɫ����