题目内容
室温下,向49.8g某浓度的氢氧化钠溶液中逐滴滴入160g质量分数为10%的CuSO4
溶液,二者恰好完全反应。试计算:
(1)该氢氧化钠溶液中NaOH的质量为 g。校对:名校资源库编辑03
(2)反应后所得溶液中溶质的质量分数是多少?
(1)8.0g (2)7.1%
解析试题分析:氢氧化钠与硫酸铜反应生成硫酸钠反应和氢氧化铜沉淀:NaOH +CuSO4 =Na2SO4+Cu(OH)2↓,利用化学方程式,根据硫酸铜的质量可求出溶质氢氧化钠的质量和生成的硫酸钠的质量。
160g质量分数为10%的CuSO4溶液中溶质硫酸铜的质量=160g×10%=16g
设氢氧化钠溶液中NaOH的质量为x,
生成的硫酸钠的质量为y;生成氢氧化铜的质量为z;
2NaOH +CuSO4 =Na2SO4+Cu(OH)2↓
80 160 142 98
X 16g y z
80/x =160/16g 142/y =160/16g 98/z =160/16g
X=8g y= 14.2g z=9.8g
反应后溶液的质量=49.8g+160g-9.8g=200g
反应后所得溶液中溶质的质量分数=14.2g/200g ×100% =7.1%
考点:利用化学方程式的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
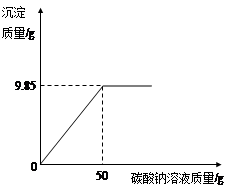

 Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)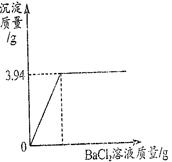
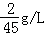 .试求:
.试求: