题目内容
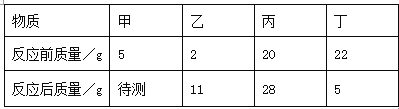
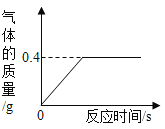
【题目】有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将![]() 样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示
样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示![]() 试求:
试求:
![]() 样品中金属铜的质量是______
样品中金属铜的质量是______ ![]()
![]() 所用稀硫酸的溶质质量分数_________
所用稀硫酸的溶质质量分数_________![]() 写出计算过程
写出计算过程![]() .
.
【答案】 ![]()
![]()
【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑
65 98 2
x y 0.4g
![]()
x=13g
y=19.6g
混合物中铜的质量为32.5g-13g=19.5g
所以稀硫酸中溶质的质量分数为![]()
答:(1)样品中金属铜的质量是19.5g。(2)所用稀硫酸中溶质的质量分数为19.6%。

练习册系列答案
相关题目