题目内容
【题目】碳酸镁水合物是制备镁产品的中间体. 【制取MgCO33H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
(1)沉淀过程的化学方程式为: MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2 .
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为(填字母). 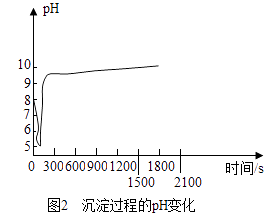
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26﹣1所示. 
表26﹣1 不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为 , 理由是 .
(4)【测定MgCO33H2O的纯度】 利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度.
依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有 .
(5)C中反应生成CaCO3的化学方程式为;D中碱石灰的作用为 .
(6)下列各项措施中,不能提高测定准确度的是(填标号). a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(7)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度(写出计算过程).
(8)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有 .
(9)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数(填“偏大”“不变”或“偏小”,下同),样品中MgCO33H2O的纯度 .
【答案】
(1)NaCl
(2)c
(3)48.95℃;此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀
(4)把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收
(5)Ca(OH)2+CO2═CaCO3↓+H2O;防止空气中的CO2进入C装置干扰实验
(6)bc
(7)92.0%
(8)BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小
(9)偏大;偏大
【解析】解:【制取MgCO33H2O】(1)由反应的化学方程式可知,反应前后镁原子都是1个,碳原子都是1个,氧原子都是6个,氢原子都是6个,反应前氯原子和钠原子都是2个,都包含在未知物质中,因此未知物质是氯化钠. 故填:NaCl.(2)沉淀过程的pH随时间的变化如图2所示,弱碱性卤水的pH大于7,开始时pH逐渐减小,说明加入了二氧化碳,一会儿后pH升高,说明加入了氢氧化钠溶液,同时继续通入二氧化碳,使反应继续进行.
故选:c.(3)由表中数据可知,沉淀过程选择的温度为48.95℃,这是因为此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀.
故填:48.95℃;此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀.【测定MgCO33H2O的纯度】(4)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.
故填:把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.(5)C中氢氧化钙和二氧化碳反应生成碳酸钙和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验.
故填:Ca(OH)2+CO2═CaCO3↓+H2O;防止空气中的CO2进入C装置干扰实验.(6)a.在加入硫酸之前,应排净装置内的CO2气体,这样能够防止空气中的二氧化碳和氢氧化钙反应生成碳酸钙,影响实验结果,该选项能提高测定准确度;
b.快速滴加硫酸,可能会导致产生的二氧化碳气体不能被氢氧化钙溶液全部吸收,从而导致实验结果不准确,该选项不能提高测定准确度;
c.在A~B之间增添盛有浓硫酸的洗气装置时能够吸收水蒸气,但是通过B装置后又会带进水蒸气,该选项不能提高测定准确度;
d.在C装置左侧导管末端增添多孔球泡,能够增大二氧化碳和氢氧化钙的接触面积,利于二氧化碳气体的全部吸收,该选项能提高测定准确度.
故选:bc.(7)解:设MgCO33H2O的质量为x,
MgCO33H2O~CO2~ | CaCO3 |
138 | 100 |
x | 10.0g |
![]() =
= ![]() ,
,
x=13.8g
MgCO33H2O的纯度为: ![]() ×100%=92.0%,
×100%=92.0%,
故填:92.0%.(8)将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.
故填:BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.(9)MgCO33H2O中镁元素、碳元素质量分数分别为: ![]() ×100%=17.4%,
×100%=17.4%, ![]() ×100%=8.7%,
×100%=8.7%,
Mg5(OH)2(CO3)44H2O中镁元素、碳元素质量分数分别为: ![]() ×100%=25.8%,
×100%=25.8%, ![]() ×100%=10.3%,
×100%=10.3%,
由计算可知,MgCO33H2O中的镁元素、碳元素质量分数都小于Mg5(OH)2(CO3)44H2O中的镁元素、碳元素质量分数,因此若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数偏大,样品中MgCO33H2O的纯度偏大.
故填:偏大;偏大.
【制取MgCO33H2O】
化学反应前后,元素种类不变,原子种类和总个数都不变;
根据溶液pH的变化情况可以判断操作过程;
根据表中和图中提供的数据、信息可以判断相关方面的问题;
【测定MgCO33H2O的纯度】
不同的实验装置,功能不同;
二氧化碳能使澄清石灰水变浑浊,是因为二氧化碳和氢氧化钙反应生成了白色沉淀碳酸钙和水;根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断;碳酸钡的相对分子质量是197,碳酸钙的相对分子质量是100;若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,根据物质中组成元素的含量可以判断计算结果.

