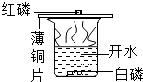
题目内容
【题目】下列图象能正确反映其对应操作中各量变化关系的是( ) 
A.①表示向等质量的镁和锌分别加入足量等体积等质量分数的稀硫酸(一次加入,而非逐滴滴加)
B.②表示向硫酸锌溶液中加入足量铁粉
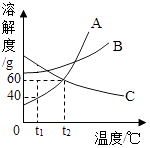
C.③表示向接近饱和的硝酸钾溶液中加入一定量的硝酸钾
D.④表示在密闭容器内燃烧镁带
【答案】D
【解析】解:A、由金属活动性顺序可知镁的活动性比锌强,所以与相同的稀硫酸反应时,镁反应的速度会更快一些,图象的斜率镁应比锌大,即应该陡一点,故错误; B、由金属活动性顺序可知锌的活动性比铁强,所以铁不能置换出硫酸锌中的锌,所以溶液的质量会一直不变,图象反应溶液的质量存在变化,故错误;
C、接近饱和的硝酸钾溶液中加入一定量的硝酸钾,开始硝酸钾会继续溶解直至溶液饱和,所以溶液中溶质的质量分数的变化是开始变大最后不变,图象反应随着硝酸钾的不断加入,溶质的质量分数不断变大,故错误;
D、根据质量守恒定律的原理可知:在密闭容器内燃烧镁带时不管镁与氧气反应进行的情况如何,镁元素的质量会一直不变,图象反映正确;
故选D
【考点精析】本题主要考查了饱和溶液和不饱和溶液和金属材料的选择依据的相关知识点,需要掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】碳酸镁水合物是制备镁产品的中间体. 【制取MgCO33H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1: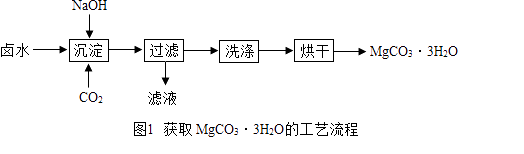
(1)沉淀过程的化学方程式为: MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2 .
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为(填字母). 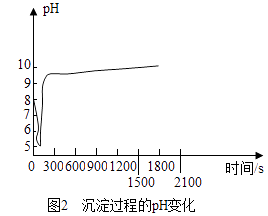
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26﹣1所示. 
表26﹣1 不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为 , 理由是 .
(4)【测定MgCO33H2O的纯度】 利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度.
依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有 .
(5)C中反应生成CaCO3的化学方程式为;D中碱石灰的作用为 .
(6)下列各项措施中,不能提高测定准确度的是(填标号). a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(7)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO33H2O的纯度(写出计算过程).
(8)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有 .
(9)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则产品中镁元素的质量分数(填“偏大”“不变”或“偏小”,下同),样品中MgCO33H2O的纯度 .