题目内容
【题目】向 AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入一定量的铁粉,充分反应后过滤,得滤渣和滤液。下列判断错误的是( )
A. 滤液中一定有 Fe(NO3)2和Mg(NO3)2
B. 向滤渣中加入稀盐酸,可能有气泡产生
C. 与原溶液相比,滤液的质量可能增大
D. 向滤液中滴入稀盐酸,可能会有白色沉淀出现
【答案】C
【解析】
由于镁、铁、铜、银的金属活动性顺序是:镁>铁>铜>银,把一定量的铁放到AgNO3、Cu(NO2)2、Mg(NO3)2 的混合溶液中,铁首先和AgNO3反应生成了硝酸亚铁和银,再和CuSO4反应生成了硝酸亚铁和铜,而不能与Mg(NO3)2反应。
A.由分析可知,滤液中一定有 Fe(NO3)2、Mg(NO3)2,故正确,不符合题意;
B.若铁是过量的,铁有剩余,滤渣中加入稀盐酸,就有气泡产生,故正确,不符合题意;
![]()
![]()
由化学方程式可知,铁与硝酸银、硝酸铜反应都会使溶液的质量减小,滤液的质量不可能增大,故错误,符合题意;
D.若铁的质量不足,滤液中有剩余的AgNO3,向滤液中滴入稀盐酸,就会有氯化银白色沉淀出现,故D正确,不符合题意。故选:C。

 名校课堂系列答案
名校课堂系列答案【题目】某班两组同学利用稀硫酸和氢氧化钠溶液进行了如下实验:
(1)第一小组同学测量9.8%的稀硫酸和10%的氢氧化钠溶液中和反应过程中温度的变化。
①第一步:关于溶液的配制和保存
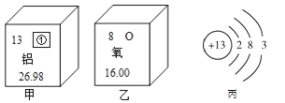
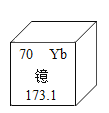
首先,该小组同学将配制好的10%的氢氧化钠溶液,倒入带_____塞的细口瓶中,备用。其次,该组同学用如表标签所示的浓硫酸配制100g溶质质量分数为9.8%的稀硫酸。请列式计算所需水的体积_____。
硫酸
化学式H2SO4
相对分子质量98
质量分数98%
本试剂为无色透明的粘稠液体
有腐蚀性!
②该小组同学量取了8组均为8mL的氢氧化钠溶液,分别向其中加入一定体积的稀硫酸,测得温度变化如表所示:
实验组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
加入稀硫酸的体积 (V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液温度上升 (△t)/℃ | 4.8 | 8.4 | 11.2 | 11.1 | 13.1 | 11.4 | 10.2 | 9.2 |
其中实验组别为_____(填实验组别的序号)的一组数据明显不合理,判断理由是_____。
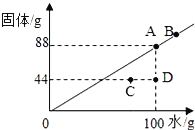
(2)第二小组同学计划探究中和反应过程中的pH变化情况。他们取稀释后的氢氧化钠溶液25g,向其中加入溶质质量分数为9.8%的稀硫酸,加入稀硫酸的质量与溶液pH的变化情况如图所示。计算:

①当两者恰好完全中和时,所得溶液中溶质的质量分数_____。(计算结果精确到0.1%)
②已知:20℃时硫酸钠的溶解度为19.5g。若要将反应后所得溶液恰好转化为20℃时的饱和溶液,最简单的方法是_____。