题目内容
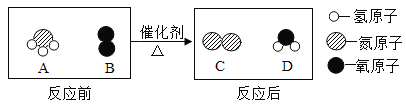
【题目】草酸(H2C2O4)又名乙二酸,是一种有机酸易溶于水,广泛存在于植物源食品中,草酸不稳定,在浓硫酸的催化作用下,草酸固体受热分解生成碳的氧化物和水,某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究
(查阅资料)①CO2+2NaOH===Na2CO3+H20 ②浓硫酸具有吸水性
(提出问题)生成物中有哪几种碳的氧化物?
(实验猜想)猜想1:只有CO;
猜想2:只有____________(填化学式);
猜想3:含有CO和CO2。
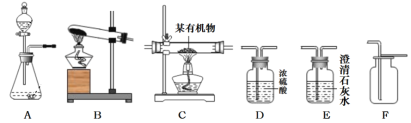
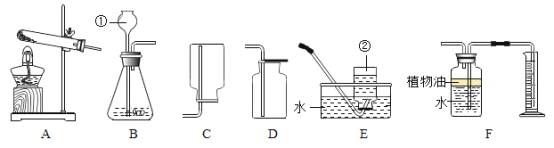
(设计实验)基于猜想3,根据CO和CO2的性质兴趣小组同学设计了如下实验:

A B C D E F
(实验探究)
(1)观察到A装置中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成,请写出A装置中的化学反应方程式__________________________ ;
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO;
①C装置中澄清石灰水_________________,F装置中出现浑浊的现象;
②E装置中出现____________________ 的现象。
(实验结论)通过实验探究证明:猜想3成立
草酸分解的化学方程式是_______________________ 。
(问题讨论)
(1)B装置的作用是 ___________________________________ ;
(2)C装置的作用是 ____________________________________;
(3)该试验装置的设计还有一处明显不足(实验前已排尽装置内的空气)
请提出改进措施__________________________________________________ (任写一条)
【答案】只有CO2 CO2+Ca(OH)2= CaCO3↓+H2O 无明显现象 黑色固体变红色 H2C2O4![]() CO↑+ CO2↑+ H2O 除尽草酸分解生成的二氧化碳 检验二氧化碳是否被除尽 放一盏燃着的酒精灯
CO↑+ CO2↑+ H2O 除尽草酸分解生成的二氧化碳 检验二氧化碳是否被除尽 放一盏燃着的酒精灯
【解析】
[实验猜想]
碳的氧化物有一氧化碳和二氧化碳,根据猜想一和三可知猜想二是只有二氧化碳,故填只有CO2;
[实验探究]
(1)观察到A装置中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成,二氧化碳和澄清石灰水反应生成碳酸钙沉淀和水,方程式故填CO2+Ca(OH)2= CaCO3↓+H2O;
(2)
①利用装置B除掉可能存在的二氧化碳,排除二氧化碳的干扰,C装置中澄清石灰水无明显现象,然后利用一氧化碳还原氧化铜生成的二氧化碳,使F装置中出现澄清石灰水变浑浊的现象,说明草酸分解的气体中含有CO,故填无明显现象;
②一氧化碳具有还原性,和氧化铜在加热条件下生成铜和二氧化碳,装置E中观察到黑色固体变红色,也能说明草酸分解的气体中含有CO,故填黑色固体变红色;
[实验结论]
猜想3成立说明草酸分解生成一氧化碳和二氧化碳和水,方程式故填H2C2O4![]() CO↑+ CO2↑+ H2O;
CO↑+ CO2↑+ H2O;
[问题讨论]
(1)通过装置A检验草酸分解生成的二氧化碳气体,再通过装置B大量吸收二氧化碳,以除尽二氧化碳气体,为一氧化碳检验排除干扰,B装置的作用故填除尽草酸分解生成的二氧化碳;
(2)C装置的作用是检验二氧化碳是否被除尽,故填检验二氧化碳是否被除尽;
(3)一氧化碳有毒,是大气污染物,实验时应有尾气处理装置,可以在F装置的末端加气袋进行收集,或者放一盏燃着的酒精灯,改进措施故填放一盏燃着的酒精灯。

【题目】为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案。方案甲:称得生锈铁片的质量为 m1g,按图 I 所示装置进行实验。完全反应后,测得室温下产生氢气的体积为 V1L,查得其密度为p1g/L。方案乙:称得生锈铁片的质量为 m2g,先按图Ⅱ所示装置进行实验。当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温。取出铁片,按图 I 所示装置继续进行实验。完全反应后,测得室温下产生氢气的体积为 V2L,查得其密度为 p2g/L。
已知:Fe2O3+6HCl=2FeCl3+3H2O(FeCl3可溶于水)
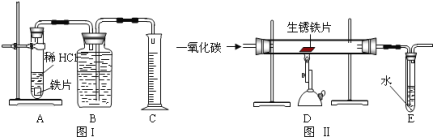
(1)铁锈的成分是__________.
(2)(评价交流)上述两个方案中,可行的是____(填“甲”或“乙”);分析不可行方案,其缺陷是____________________。
(3)(设计实验)方案乙中,同学们设计了如下实验报告,请帮助完成表中空格。
实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
①装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性; 化学方程式:_______ |
②装置Ⅰ | 将光亮铁片放入稀盐酸中,完全反应 | ______ |
(4)图Ⅱ所示装置有缺陷,应如何改进__________。
(5)(结论)生锈铁片中铁元素的质量分数是_________(用字母表示)。
(6)(发散)实验室经常用一氧化碳来炼铁,实验室炼的铁和工业炼的铁本质区别是_______________