��Ŀ����
����Ŀ��������һ����Ҫ����Ȼ��Դ��
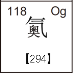
��1��ʳ��ĸ�����Ҫ������е�______�����йأ�Ϊ�ӳ�ʳƷ�����ڣ�������ʳƷ��װ���г�������к����������壬��������__���ѧʽ����
��2��������һ��ϡ�����壬�仯ѧʽΪ__���������������̽����������������______�����ʡ������������������ȣ��ú������������ŵ���______��
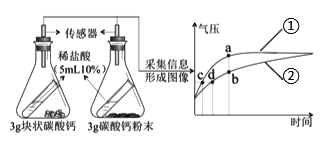
��3����ͼ�����ֲⶨ����������������װ��ͼ��
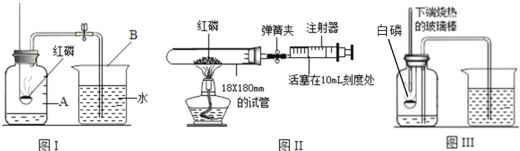
��ͼIʵ���к���ȼ�յ�������______����Ӧ�Ļ�ѧʽ����ʽΪ______��
��ͼIIʵ���м��װ�������Եķ�����______���Թܵ��п��������ԼΪ40������ȼ�պ���ʱ���ɼд��ڹر�״̬�����Թ���ȴ���ɼУ�������ע������������Ӧͣ���ڿ̶�______mL����
��ͼIIIʵ������м���ƿ��Һ��仯��______����ͼIʵ����Ƚϣ���ʵ����е��ŵ���______��
A.����Ҫ��������ƿ���ȼ�ٲ��뼯��ƿ������ʹ�ⶨ�����ȷ
B.����ȼ��ʱ������ƿ�е�ˮ����������ѹ������
C.���Լ��ٻ�����Ⱦ
��4����ͼ�����Կ�����������Ҫ��ԭ�Ϻϳɵ���̼����泥�NH4HCO3�������̣��밴Ҫ��ش��������⣺
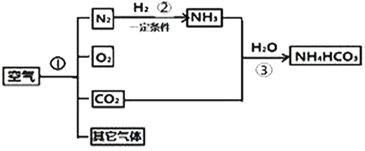
�ٲ���I���Ը���Һ̬����Һ̬����______��ͬ����Һ̬������õ������������ù�������______�仯��
��д��������з�����Ӧ�Ļ�ѧʽ����ʽ______��
�۾ݹ��ұ���̼����炙����д�̼����淋ĺ������õ���95�������ý�̼����炙��������Һ��Ӧ�������е�Ԫ��ȫ��ת��Ϊ�������ⶨ�����е�Ԫ�صĺ����������������ɷֲ���������ȡij̼����炙�����Ʒ8.0����������Һ��Ӧ�õ��������������±���ʾ��
������� | 1 | 2 | 3 |
��Ʒ������g�� | 8.00 | 8.00 | 8.00 |
����������g�� | 1.71 | 1.69 | 1.70 |
ͨ���������ݼ���û�����̼����淋ĺ����Ƿ�ﵽ���ұ�����д��������̣���______��
���𰸡�������O2�� N2 He �ܶȺ�С ���Ӱ�ȫ������ȼ�ա����ᱬը�ȣ� ������������ P+O2![]() P2O5 ���ɼУ���ע��������������һ�ξ��룬�ɿ��ֺ�ע���������ص�ԭλ��˵����©�����������ɣ� 2 ���½������� ABC �е� ���� N2 +3 H2
P2O5 ���ɼУ���ע��������������һ�ξ��룬�ɿ��ֺ�ע���������ص�ԭλ��˵����©�����������ɣ� 2 ���½������� ABC �е� ���� N2 +3 H2![]() 2NH3 �ﵽ���ұ�
2NH3 �ﵽ���ұ�
��������
��4���۸��ݲ���������������������ɰ�����ƽ��ֵ������������е�Ԫ�ص��������ٸ��ݵ�Ԫ�ص��������̼����淋�������Ȼ��������û�����̼����淋����������������бȽϼ��ɡ�
��1�������Ļ�ѧ���ʱȽϻ�������ʳ��ĸ�����Ҫ������е�������O2���йأ�Ϊ�ӳ�ʳƷ�����ڣ�������ʳƷ��װ���г�������к����������嵪������������N2��
��2��������һ��ϡ�����壬�仯ѧʽΪHe���������������̽�����������������ܶȺ�С�����ʡ������������������ȣ��ú������������ŵ��������Ӱ�ȫ��
��3����ͼIʵ���к���ȼ�յ��������������������̣���Ӧ�Ļ�ѧʽ����ʽΪ��P+O2![]() P2O5��
P2O5��
��ͼIIʵ���м��װ�������Եķ����������ɼУ���ע��������������һ�ξ��룬�ɿ��ֺ�ע���������ص�ԭλ��˵����©�����Թܵ��п��������ԼΪ40������ȼ�պ���ʱ���ɼд��ڹر�״̬����������Լռ������������֮һ��������ȫȼ��Լ��������������Ϊ40mL��![]() =8mL���ʵ��Թ���ȴ���ɼУ�������ע������������Ӧͣ���ڿ̶�10mL-8mL=2mL����
=8mL���ʵ��Թ���ȴ���ɼУ�������ע������������Ӧͣ���ڿ̶�10mL-8mL=2mL����
�ۺ���ȼ�շų��������ȣ�����ƿ��ѹǿ����ˮѹ�뵼���У���ȴ�����ں���ȼ������������������ƿ��ѹǿ���ͣ��ڴ���ѹ�������£����ձ��е�ˮѹ�뼯��ƿ�С���ͼIIIʵ������м���ƿ��Һ��仯�������½�����������ͼIʵ����Ƚϣ���ʵ�鲻��Ҫ��������ƿ���ȼ�ٲ��뼯��ƿ�����Լ�����Ⱦ��Ҳ���������ȼ�ճײ�Ѹ�������������ݳ�������ʹ�ⶨ�����ȷ��ͬʱ����ƿ�е�ˮ����������ѹ����������ѡABC��
��4���ٲ���I���Ը���Һ̬����Һ̬���ķе㲻ͬ����Һ̬������õ������������ù������������仯��
��������ͼ��֪��������з����ķ�Ӧ�ǵ�����������һ�������·�Ӧ���ɰ�������Ӧ�Ļ�ѧʽ����ʽΪ��N2 +3 H2![]() 2NH3��
2NH3��
�۰�����ƽ������=��1.71g+1.69g+1.70g����3=1.70g
�����е�Ԫ�ص�����= 1.70g��![]() =1.4g
=1.4g
̼����淋�����=1.4g��![]() = 7.9g
= 7.9g
������̼����淋���������=![]() ��100% = 98.75% �� 95%
��100% = 98.75% �� 95%
���Ըû�����̼����淋ĺ����ﵽ���ұ���

 С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�����Ŀ��ij��ѧ��ȤС���ͬѧ�������к�����һЩ���ʲ�������Ȥ��������һϵ��̽���������һͬ���롣
��̽��һ������˿ȼ���Ƿ���Ҫ����
��ʵ�����ݣ���ȡ������ֱͬ����Ϊ0.38mm����˿���ֱ���O2������ͬ�������ʵ�顣
��ʵ������
O2% | 90% | 70% | 60% | 55% |
ʵ������ | ȼ�վ��ң�ȼ��ʱ�䳤��Ч���� | ȼ�ձ�90%����ȼ��ʱ��̣�ʵ��ɹ� | ȼ�ձ�70%����ȼ��ʱ����̣�ʵ��ɹ� | ����ȼ�գ�ֻ�Ƿ��� |
��1��������˿��������ȼ�յ�ʵ��ʱ�������____���ռ����÷�Ӧ�ķ��ű���ʽΪ___��
��2��������ͼ1װ���ռ�һƿ��150mL�����������������ԼΪ60%�����壬�����ǣ���150mL����ƿ��װ��ˮ�������������رջ���b������aͨ����������ƿ���ˮ������Ͳ������Ͳ�ڵ�ˮ�ﵽ�趨������������رջ���a��Ȼ�����bͨ���������ƿ���ˮȫ��������Ͳ����ֹͣͨ������ʱ��Ͳ��ˮ�����ԼΪ_______����ʾ���������������������ԼΪ1/5 ����
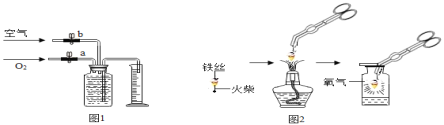
�����ۣ�����0.38mm��˿���ԣ�ȼ����������������������Ϊ����55%��������Ũ��Խ��ȼ������Խ__________��������ҡ������ҡ�����
��̽����������˿ȼ�ղ������������ԭ��
���������ϣ�
���ճ������еĸ�����Ʒ����������̼���ʡ�
�ں�̼ϸ��˿ȼ��ʱ�����е�̿�����ɵ�CO2����������Һ̬�������γ����ݣ�����Һ̬����������ը�����𡰻������䡱������
��ʵ�����ݣ�ȡ������ͬ��ֱ����Ϊ0.20mm����̼����ͬ����˿�ֱ���������������ȼ�գ��۲�����
��1��С����ͼ2ʵ��ʱ������ƿ�з�ˮ��Ŀ����______��
��2���±�������������˿����������ȼ��ʱ��ʵ������ļ�¼�������������±���
���� | ����˿ | ��̼0.05%����˿ | ��̼0.2%����˿ | ��̼0.6%����˿ |
ȼ��ʱ ������ | �������������۶� | ����ȼ�գ����ٻ��� | ����ȼ�գ��������� | _________ |
��3��ͨ������ʵ�飬˵����˿ȼ�ղ����������������________����Ԫ�ط��ţ��йء�
��̽���������û�ѧ��ȤС�黹�Ժ������۵ġ�ů����������̽���������÷���ԭ���ⶨ���������������������
���������ϣ�
��ů�������к������ۡ�����̿��ˮ���Ȼ��Ƶ����ʡ�������������Ӧ�ı���ʽ�ǣ� Fe+O2+H2O��Fe(OH)2���ù��̷��ȡ�

��ʵ��عˣ�
ͼ1��ʵ�����ú���ȼ�������Բⶨ����������������װ�á�
ʵ��ԭ�������ں���ȼ�����Ŀ����е�������ʹƿ��______��С����Ͳ��ˮ����������ƿ����װ�õ����������ã������淶�����Ը�����Ͳ�в������ƿ�е�ˮ����������Բ�ÿ����������ĺ�����
�����������
��ʵ�����ϱ�����ȼ�չ����е����������������7% ʱ������������ȼ�գ����ͨ������ʵ�飬���ý��������ֵ���ϴ�
��ʵ��Ľ�1��
ͼ2�����ڿ����з�Ӧ��ʵ��װ�ã���װ���б���ʳ��ˮ������̿��������������з�Ӧ���ٶȣ�����ȤС���ͬѧ���ø�װ�ã��ٴβⶨ����������������
�������뽻����
��ʵ��ԭ���Ƕȷ������Ľ����ʵ������ǰ��ȷ�ȸ��{��ԭ����_________��
����˼���ۣ��øĽ�װ�ô��ڲ����Ӱ��ʵ������ԭ����________��
��ʵ��Ľ�2��
��ͬѧ������ͼ1װ�ã����á�ů�������е����ʴ��������ȼ�գ��������������IJⶨ������Ϊ�Ƿ���У���˵������__________
��֪ʶ��չ��
��֪ij�����������У���Ԫ�غ���Ԫ�ص�������Ϊ7��3�����������Ļ�ѧʽΪ_____��