题目内容
【题目】某化学兴趣小组的同学对铁还有含铁的一些物质产生了兴趣,进行了一系列探究活动,请你一同参与。
(探究一):铁丝燃烧是否需要纯氧
(实验内容):取长短相同直径均为0.38mm的铁丝,分别在O2含量不同的情况下实验。
(实验现象)
O2% | 90% | 70% | 60% | 55% |
实验现象 | 燃烧剧烈,燃烧时间长,效果好 | 燃烧比90%弱,燃烧时间短,实验成功 | 燃烧比70%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |
(1)在做铁丝在氧气中燃烧的实验时,最好用____法收集,该反应的符号表达式为___;
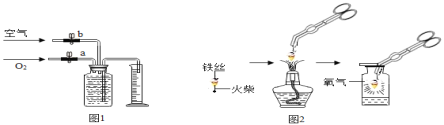
(2)若用如图1装置收集一瓶(150mL)含氧气的体积分数约为60%的气体,方法是:在150mL集气瓶里装满水,塞紧胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒。则停止通入氧气时量筒内水的体积约为_______(提示:空气中氧气的体积分数约为1/5 )。
(结论):就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为大于55%,且氧气浓度越大,燃烧现象越__________。(填“剧烈”或“不剧烈”);
(探究二):铁丝燃烧产生火星四射的原因
(查阅资料)
①日常生活中的钢铁制品都含有少量碳杂质。
②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
(实验内容)取长短相同、直径均为0.20mm、含碳量不同的铁丝分别在足量的氧气中燃烧,观察现象
(1)小明按图2实验时,集气瓶中放水的目的是______;
(2)下表是他将几种铁丝放入氧气中燃烧时的实验现象的记录。请你分析完成下表:
物质 | 纯铁丝 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时 的现象 | 无火星四射现象,熔断 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 | _________ |
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和________(填元素符号)有关。
(探究三):该化学兴趣小组还对含有铁粉的“暖宝宝”进行探究,并利用发热原理测定空气中氧气的体积分数。
(查阅资料)
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质。遇空气发生反应的表达式是: Fe+O2+H2O→Fe(OH)2,该过程放热。

(实验回顾)
图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内______减小,量筒中水倒吸到集气瓶。若装置的气密性良好,操作规范,可以根据量筒中测出进入瓶中的水的体积,粗略测得空气中氧气的含量。
(问题提出)
有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
(实验改进1)
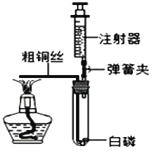
图2是铁在空气中反应的实验装置(该装置中饱和食盐水、活性炭会加速铁在氧气中反应的速度)。兴趣小组的同学利用该装置,再次测定空气中氧气含量。
(表达与交流)
从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是_________;
(反思评价)该改进装置存在不足会影响实验结果,原因是________。
(实验改进2)
丁同学设想用图1装置,换用“暖宝宝”中的物质代替红磷将其燃烧,进行氧气含量的测定,你认为是否可行,并说明理由__________
(知识拓展)
已知某铁的氧化物中,铁元素和氧元素的质量比为7:3,则该氧化物的化学式为_____。
【答案】排水法 Fe + O2 ![]() Fe3O4 75ml 剧烈 防止生成固体溅落,炸裂瓶底 剧烈燃烧 ,火星四射 C 压强 改进后的实验能更彻底的消耗氧气 没有用弹簧夹夹紧橡皮管,瓶中反应放热,使瓶内气体受热膨胀而逸出 不可行,暖宝宝中的活性炭会燃烧生成二氧化碳气体,影响实验结果 Fe2O3
Fe3O4 75ml 剧烈 防止生成固体溅落,炸裂瓶底 剧烈燃烧 ,火星四射 C 压强 改进后的实验能更彻底的消耗氧气 没有用弹簧夹夹紧橡皮管,瓶中反应放热,使瓶内气体受热膨胀而逸出 不可行,暖宝宝中的活性炭会燃烧生成二氧化碳气体,影响实验结果 Fe2O3
【解析】
探究一:(1)依据氧气不易溶于水及所用的是不同体积分数的氧气分析解答;
(2)本题需要考虑空气中氧气的含量和收集的氧气的综合占比为60%,再依据收集装置的特点和数据解答量筒内水的体积;根据实验现象中的数据情况可以判断铁丝燃烧所需氧气的最低体积分数,并且能够判断影响铁丝燃烧剧烈程度的因素;
探究二:
根据实验现象可以判断随着含碳量的变化,是否出现火星及其剧烈程度的情况进行解答;
探究三:
实验回顾:根据测量原理进行分析解答;
交流与表达:根据铁生锈的知识进行分析解答即可;
反思评价:根据测定空气中氧气含量的装置要密封进行分析解答;
实验改进2:根据碳燃烧消耗氧气的同时,生成了二氧化碳气体进行分析解答;
知识拓展:根据质量比求出原子的个数比。
探究一:(1)氧气不易溶于水,且要使用不同体积分数的氧气来进行实验。 故可用排水法收集不同体积氧气;铁在氧气中燃烧生成四氧化三铁,反应的符号表达式是Fe + O2 ![]() Fe3O4;
Fe3O4;
(2)这一瓶气体中氧气的总量为150mL×60%=90mL,氮气的体积是:150mL-90mL=60mL;空气的体积是:60mL÷![]() =75mL,那么停止通入氧气时量筒内水的体积约为:150mL-75mL=75mL;由于0.38mm的铁丝在60%的氧气中还能够燃烧,在55%时已经不能燃烧的事实可知:根据实验现象可知,就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为大于55%,且氧气浓度越大,燃烧现象越剧烈;
=75mL,那么停止通入氧气时量筒内水的体积约为:150mL-75mL=75mL;由于0.38mm的铁丝在60%的氧气中还能够燃烧,在55%时已经不能燃烧的事实可知:根据实验现象可知,就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为大于55%,且氧气浓度越大,燃烧现象越剧烈;
探究二:(1)铁丝燃烧后的生成物温度很高,容易炸裂瓶底,所需要在实验用集气瓶底部放入少量水或细沙,以防止炸裂瓶底;
(2)由实验现象可知,随着铁丝中含碳量的升高,铁丝燃烧越来越剧烈,火星越来越多,含碳0.6%的铁丝能够在氧气中剧烈的燃烧,火星四射;
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和碳元素的含量有关,碳元素的元素符号是C;
探究三:
实验回顾:实验原理:由于红磷燃烧消耗空气中的氧气,瓶内的气体质量减小,使瓶内压强减小,量筒中水倒吸到集气瓶;
表达与交流:从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是改进后的实验能更彻底的消耗氧气,实验结果更准确;
反思评价:该改进装置存在不足会影响实验结果,原因是没有用弹簧夹夹紧橡皮管,瓶中反应放热,使瓶内气体受热膨胀而逸出,实验结果偏大;
实验改进2:丁同学设想用图1装置,换用“暖宝宝”中的物质代替红磷将其燃烧,进行氧气含量的测定,你认为是否可行,并说明理由不可行,暖宝宝中的活性炭会燃烧生成二氧化碳气体,瓶内的气压降低不明显,影响实验结果;
知识拓展:设:铁的氧化物中Fe、O的原子个数为a、b,则由Fe、O元素的质量比为7:3,则有:56a:16b=7:3,a:b=2:3,该氧化物的化学式为Fe2O3。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】空气是一种重要的自然资源。
(1)食物的腐败主要与空气中的______气体有关,为延长食品保质期,常常在食品包装袋中充入空气中含量最多的气体,该气体是__(填化学式)。
(2)氦气是一种稀有气体,其化学式为__,氦气可用于填充探空气球,这是利用它______的性质。与用氢气填充气球相比,用氦气填充气球的优点是______。
(3)下图是三种测定空气中氧气含量的装置图:
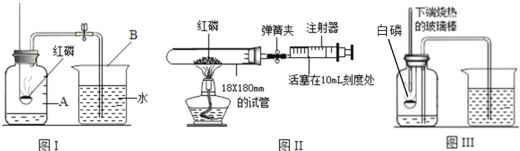
①图I实验中红磷燃烧的现象是______,反应的化学式表达式为______。
②图II实验中检查装置气密性的方法是______,试管的中空气的体积约为40毫升,燃烧红磷时弹簧夹处于关闭状态,等试管冷却打开弹簧夹,理论上注射器活塞最终应停留在刻度______mL处。
③图III实验过程中集气瓶中液面变化是______,与图I实验相比较,该实验具有的优点有______。
A.不需要将白磷在瓶外点燃再插入集气瓶,可以使测定结果更准确
B.白磷燃烧时,集气瓶中的水可以起到缓冲气压的作用
C.可以减少环境污染
(4)下图是是以空气和其他必要的原料合成氮肥碳酸氢铵(NH4HCO3)的流程.请按要求回答下列问题:
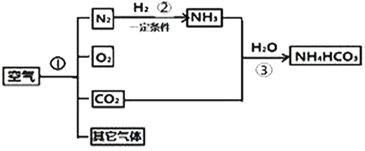
①步骤I可以根据液态氮和液态氧的______不同分离液态空气获得氮气和氧气,该过程属于______变化。
②写出步骤②中发生反应的化学式方程式______。
③据国家标准,碳酸氢铵化肥中纯碳酸氢铵的含量不得低于95%。可用将碳酸氢铵化肥与碱溶液反应,将其中氮元素全部转化为氨气来测定化肥中氮元素的含量(化肥中其他成分不含氮)。取某碳酸氢铵化肥样品8.0与足量碱溶液反应得到氨气的质量如下表所示:
试验次数 | 1 | 2 | 3 |
样品质量(g) | 8.00 | 8.00 | 8.00 |
氨气质量(g) | 1.71 | 1.69 | 1.70 |
通过以上数据计算该化肥中碳酸氢铵的含量是否达到国家标准。(写出计算过程,)______。