题目内容
【题目】氢化钙(CaH2)是一种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:![]() ,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
[提出猜想]猜想一: NaOH
猜想二: NaOH 和Ca(OH)2
猜想三: NaOH、Na2CO3
猜想四: NaOH、 Na2CO3、 Ca(OH)2
经过讨论,大家一致认为猜想四不合理,理由是(用化学方程式表示)______。
[实验验证]
实验 | 现象 | 结论 |
(1)取少量滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想___不成立 |
(2)另取少量滤液,向其中加入______ | _____ | 猜想三成立 |
[反思与拓展]若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和___。
【答案】CaCO3 ![]() 二 过量的稀盐酸 有气泡产生或有白色沉淀生成 NH3 (或氨气)
二 过量的稀盐酸 有气泡产生或有白色沉淀生成 NH3 (或氨气)
【解析】
氢化钙和水反应生成氢氧化钙和氢气,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,滤渣的主要成分是氢氧化钙和碳酸钠反应生成的碳酸钙。
故填:CaCO3。
[提出猜想]
经过分析,大家一致认为上述猜想四不合理,原因是碳酸钠能和氢氧化钙会反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式:![]() 。
。
故填:![]() 。
。
[实验验证]
(1)取少量滤液,向其中滴入少量碳酸钠溶液,无明显现象,说明溶液中不含有氢氧化钙,因为碳酸钠和氢氧化钙反应生成碳酸钙沉淀,所以猜想二不成立;
(2)另取少量滤液,向其中加入足量稀盐酸,若产生气泡,是因为碳酸钠和盐酸反应生成了二氧化碳,实验过程如下所示:
实验 | 现象 | 结论 |
(1)取少量滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
(2)另取少量滤液,向其中加入过量的稀盐酸。 | 产生气泡 | 猜想三成立 |
[反思与拓展]
若向NH4C1的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和氯化铵与氢氧化钙反应生成的氨气。
故填:NH3 (或氨气)。

【题目】2011年5月1日开始,对醉酒驾车者一律刑事拘留。下表是国家对“饮酒驾车”和“醉酒驾车”的界定标准:
饮酒驾车 | 20毫克/100毫升 ≤ 血液中的酒精含量 < 80毫克/100毫升 |
醉酒驾车 | 驾车血液中的酒精含量 ≥ 80毫克/100毫升 |
(1)某人驾车时经交警检查每100毫升血液中酒精含量为138毫克,他属于_____驾车;
(2)乙醇(C2H5OH)俗名酒精,由____种元素组成;酒精燃烧的化学方程式________。
(3)乙醇中碳、氧两元素的质量比为:____________________。
【题目】为探究酸、碱、盐的化学性质,某兴趣小组做了如下实验。试回答下列问题:
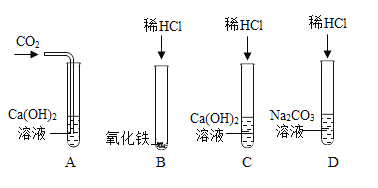
(1)试管A中的现象是__________;
(2)试管B中反应的化学方程式为__________________;
(3)甲同学把反应后C、D试管中的废液倒入一只烧杯中,观察到先有气泡产生,后有白色沉淀生成;过滤后得到白色沉淀和无色滤液。甲同学欲探究无色滤液中溶质的成分。
(提出问题)无色滤液中的溶质是什么?
(作出猜想)猜想Ⅰ:NaCl;
猜想Ⅱ:NaCl和CaCl2;
猜想Ⅲ:NaCl 和Na2CO3;
猜想Ⅳ:NaCl、CaCl2 和Na2CO3。
小明认为猜想Ⅳ一定不成立,原因是________________。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
(1)取少量滤液于试管中,滴加少量Na2CO3溶液 | 无明显现象 | 猜想___成立 |
(2)取少量滤液于试管中,滴加少量_____ | 有气泡产生 |