题目内容
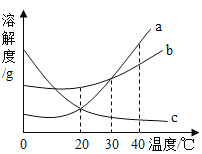
【题目】如图为A、B、C三种物质的溶解度曲线,据图回答:
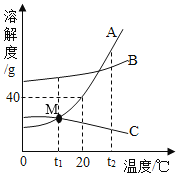
(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序是______。
(2)20℃时,将50gA物质放入100g水中,充分搅拌,所得溶液的质量是______g。
(3)若B中含有少量A,要提纯B,用______法。
(4)M点的含义是______。
(5)若将t2℃三种物质的饱和溶液分别降温到t1℃,三种溶液中溶质的质量分数由大到小是______。
【答案】A>B>C 140 蒸发结晶 t1℃时,A与C的溶解度相等 B>A>C
【解析】
(1)从t2℃处向上做垂线,观察与曲线的交点,在上面的溶解度就大,所以t2℃时A、B、C的溶解度大小顺序是A>B>C;
(2)20℃时,A物质的溶解度是40g,说明100g水中最多溶解40g,所以将50gA物质放入100g水中所得溶液,所以所得溶液质量为40g+100g=140g;
(3)溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于B的溶解度随温度变化比较小,故B中混有少量A时的提纯方法是:蒸发结晶;
(4)M点是A、C溶解度的交点,表示的含义是:t1℃时,A与C的溶解度相等;
(5)AB的溶解度随温度的降低而减小,若将t2℃A、B的饱和溶液分别降温到t1℃,二者均有晶体析出,质量分数减小,二者都是t1℃时的饱和溶液;C的溶解度随温度的降低而增大,将t2℃时C的饱和溶液降温到t1℃,溶液由饱和变为不饱和,溶质质量分数不变。根据饱和溶液中质量分数的计算式![]() ,比较三种溶液中溶质的质量分数大小,只需比较t1℃A、B的溶解度和和t2℃时C的溶解度大小即可,三种溶液中溶质的质量分数由大到小是B>A>C。
,比较三种溶液中溶质的质量分数大小,只需比较t1℃A、B的溶解度和和t2℃时C的溶解度大小即可,三种溶液中溶质的质量分数由大到小是B>A>C。

【题目】乙醇在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示:
物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量 | 4.6g | 8g | 0 | 0 | 0 |
反应后质量 | 0 | 0 | 5.4g | 4.4g | a |
下列判断正确的是()
A.表中a的值为2.6B.X一定是该反应的催化剂
C.X不一定含有碳元素D.X一定不含氮元素
【题目】氢化钙(CaH2)是一种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:![]() ,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是_____。为进一步确定滤液中所含溶质的成分,他们进行了以下实验探究。
[提出猜想]猜想一: NaOH
猜想二: NaOH 和Ca(OH)2
猜想三: NaOH、Na2CO3
猜想四: NaOH、 Na2CO3、 Ca(OH)2
经过讨论,大家一致认为猜想四不合理,理由是(用化学方程式表示)______。
[实验验证]
实验 | 现象 | 结论 |
(1)取少量滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想___不成立 |
(2)另取少量滤液,向其中加入______ | _____ | 猜想三成立 |
[反思与拓展]若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和___。