题目内容
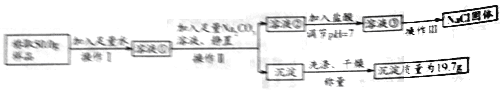
【题目】某工业铁红(Fe2O3)样品中可能混有一种黑色的金属氧化物杂质。根据工业制取铁红的流程分析,该杂质可能是FeO或CuO。兴趣小组同学为探究样品中是否含有杂质及杂质的成分,进行如下实验。
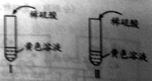
(1)甲组同学分别取质量相等的样品和Fe2O3,加入试管Ⅰ、Ⅱ中,然后加入等体积稀硫酸进行如图对照实验,并得出结论:样品中不含杂质。你认为该结论_______(填“合理”或“不合理”)。
(2)乙组同学按下列步骤进行实验:
【收集资料】
①上述三种氧化物在加热条件下,都能与氢气反应得到相应的金属单质和水。
②三种氧化物中氧元素的质量分数由大到小的顺序为____________。
③铁粉中混有少量铜时,难以从金属颜色确定是否含有金属铜。
【设计方案进行实验】
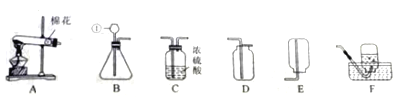
乙组同学用下图装置进行实验(碱石灰是氧化钙与氢氧化钠固体混合物)。
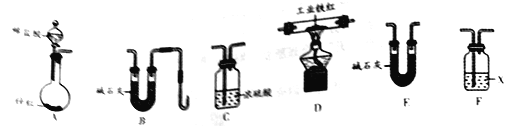
①乙组同学的实验装置中,依次连接的合理顺序为A→F→_____→_______→______→B。检验装置气密性后,向各装置中加入药品。装置F中试剂X是_____溶液,装置C的作用是___________。
②下列实验操作步骤的合理顺序是________(填写操作编号)。
a.加热装置D中反应管 b.检验H2的纯度
c.打开装置A中分液漏斗的活塞,向圆底烧瓶中加入稀盐酸
③该实验处理问起的方法是______________。
【实验分析与结论】
乙组同学的两次实验数据如下表:(两次实验工业铁红均与氢气完全反应)
实验编号 | 加入装置D中工业铁红的质量(g) | 实验后装置E的增重(g) |
1 | 8.0 | 2.6 |
2 | 16.0 | 5.2 |
①分析数据,你的实验结论是_________________。
②请帮助乙组同学设计实验方案确认该样品中杂质的成分________________。(写出操作、现象和结论,若该样品中不含杂质本题不必作答)
【答案】(1)不合理(1分)(2)②Fe2O3>FeO>CuO(1分)【设计方案进行实验】①C D E(2分)
氢氧化钠(1分) 吸收水蒸气,干燥H2(1分) ②下列实验操作步骤的合理顺序是c b a(2分)③点燃使H2燃烧或用气囊收集H2(1分)
【实验分析与结论】①该工业铁红样品中含有杂质或该工业铁红样品中含有FeO或CuO(1分)②取少量装置D中的固体于试管中,加入足量稀硫酸,振荡。若固体完全溶解,则含有FeO,若固体不完全溶解,则含CuO。(2分)
【解析】(1)固体中一定有氧化铁,和硫酸反应一定能生成硫酸铁,溶液一定显黄色;(2)②![]() ;三种氧化物中氧元素的质量分数由大到小的顺序为Fe2O3>FeO>CuO(1分)【设计方案进行实验】①乙组同学的实验装置中,依次连接的合理顺序为A→F→ C → D → E →B。检验装置气密性后,向各装置中加入药品。装置F中试剂X是 NaOH 溶液,装置C的作用是 除去气体中的水干燥H2; ②实验操作步骤的合理顺序是:打开装置A中分液漏斗的活塞,向圆底烧瓶中加入稀盐酸——收集一定量的氢气,检验H2的纯度,——将纯的氢气通入装置中,一会儿,加热装置D中反应管,否则易发生爆炸。③实验中尾气的处理方法是点燃使H2燃烧或用气囊收集H2;【实验分析与结论】①氢气与8.0g Fe2O3产生2.7g水,而8.0g FeO产生2g水或者CuO产生1.8g水,少于2.6g,所以样品中有杂质。若杂质为FeO,则产物为Fe;若杂质CuO,则产物为Cu。该工业铁红样品中含有杂质或该工业铁红样品中含有FeO或CuO(1分)②取少量装置D中的固体于试管中,加入足量稀硫酸,振荡。若固体完全溶解,则含有FeO,若固体不完全溶解,则含CuO。因氧化铜与硫酸反应生成硫酸铜,因为铁和硫酸铜反应生成铜和硫酸亚铁。
;三种氧化物中氧元素的质量分数由大到小的顺序为Fe2O3>FeO>CuO(1分)【设计方案进行实验】①乙组同学的实验装置中,依次连接的合理顺序为A→F→ C → D → E →B。检验装置气密性后,向各装置中加入药品。装置F中试剂X是 NaOH 溶液,装置C的作用是 除去气体中的水干燥H2; ②实验操作步骤的合理顺序是:打开装置A中分液漏斗的活塞,向圆底烧瓶中加入稀盐酸——收集一定量的氢气,检验H2的纯度,——将纯的氢气通入装置中,一会儿,加热装置D中反应管,否则易发生爆炸。③实验中尾气的处理方法是点燃使H2燃烧或用气囊收集H2;【实验分析与结论】①氢气与8.0g Fe2O3产生2.7g水,而8.0g FeO产生2g水或者CuO产生1.8g水,少于2.6g,所以样品中有杂质。若杂质为FeO,则产物为Fe;若杂质CuO,则产物为Cu。该工业铁红样品中含有杂质或该工业铁红样品中含有FeO或CuO(1分)②取少量装置D中的固体于试管中,加入足量稀硫酸,振荡。若固体完全溶解,则含有FeO,若固体不完全溶解,则含CuO。因氧化铜与硫酸反应生成硫酸铜,因为铁和硫酸铜反应生成铜和硫酸亚铁。