题目内容
【题目】观察下列几个实验,回答问题
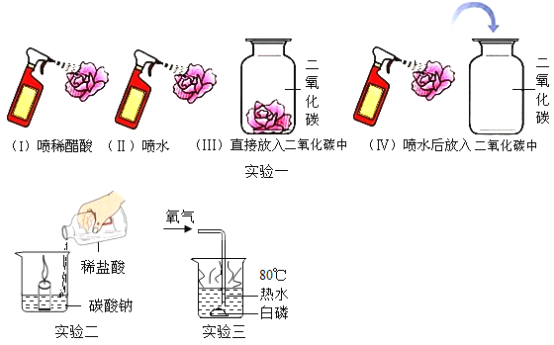
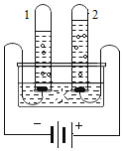
(1)实验一:该实验的目的是_____;
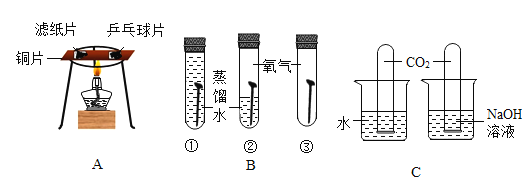
(2)实验二:能体现出二氧化碳的化学性质是_____;
(3)实验三:通氧气前白磷不燃烧,通氧气后白磷燃烧,由此得出燃烧的条件是_____;
【答案】二氧化碳与水是否反应 不燃烧、不支持燃烧 燃烧需要与氧气接触
【解析】
(1)实验一:稀醋酸显酸性,能使小花变红;(Ⅱ)说明水不能使小花变色;(Ⅲ)说明二氧化碳不能使小花变色;(Ⅳ)小花变色,说明喷水后二氧化碳和水反应生成了显酸性的物质,该实验的目的是探究二氧化碳与水是否反应,故填:二氧化碳与水是否反应;
(2)实验二:燃着的蜡烛熄灭,说明碳酸钠与盐酸反应生成的二氧化碳不燃烧、不支持燃烧,故填:不燃烧、不支持燃烧;
(3)实验三:通氧气前白磷不燃烧,通氧气后白磷燃烧,由此得出燃烧的条件是燃烧需要与氧气接触,故填:燃烧需要与氧气接触。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
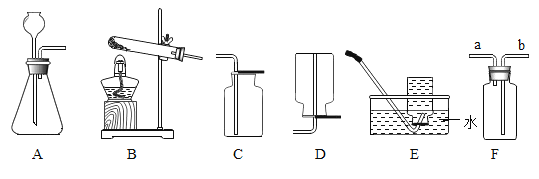
同步奥数系列答案【题目】化学小组同学利用下图装置分别完成2个实验。
序号 | 甲 | 乙 | 分液漏斗 |
1 | 大理石 | 澄清石灰水 | 稀盐酸 |
2 | 二氧化锰 | 80℃热水及一小块白磷 | 过氧化氢溶液 |

(1)实验1:打开b和a,将分液漏斗中过量的盐酸注入,关闭a,此时乙中反应的化学方程式是_____,一段时间后,关闭b,观察到乙中液体变澄清,产生此现象的原因是_____。
(2)实验2:观察到乙中白磷的现象是_____;打开b和a,当分液漏斗中的过氧化氢溶液全部注入后,关闭a,观察到乙中白磷的现象是_____。关闭b,一段时间后,白磷的现象及原因是_____。
【题目】根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题。

温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)在60℃时,NaCl的溶解度为_____g。
(2)30℃时,硝酸钾饱和溶液和氯化钠饱和溶液各100g,分别蒸发掉10g水,恢复至30℃时,_____饱和溶液析出的晶体多。
(3)要将KNO3从其饱和溶液中全部结晶出来,应该采用的方法是_____(填“冷却热饱和溶液”或“蒸发溶剂”)