题目内容
【题目】从陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如下。请回答下列问题:

(1)画出硅原子的结构示意图____________ ,它位于第几周期_________ 。
(2)甲物质中两种元素的质量比为______。
(3)该反应的化学方程式为_____________________。
(4)反应后硅元素的化合价______(选填“升高”、“降低”或“不变”)。
【答案】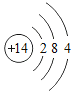 三 14:71 SiCl4+2H2
三 14:71 SiCl4+2H2![]() Si+4HCl 降低
Si+4HCl 降低
【解析】
由工业制取高纯硅的部分反应原理的微观示意图可知,该反应的化学方程式是:SiCl4+2H2![]() Si+4HCl;
Si+4HCl;
(1)硅原子核内有14个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有4个电子,其原子结构示意图为 ,为第三周期元素。
,为第三周期元素。
(2)甲物质为SiCl4,硅、氯两种元素的质量比为:28:(35.5×4)=14:71;
(3)根据微观示意图可知,该反应是四氯化硅与氢气在高温条件下生成硅和氯化氢,反应的化学方程式是:SiCl4+2H2![]() Si+4HCl;
Si+4HCl;
(4)反应前氯化硅中硅元素的化合价为+4价,反应后硅元素的化合价为0价,故降低。

【题目】取10g石灰石样品于烧杯中,再向其中加入足量稀盐酸(杂质不反应),有关实验数据见下表:
反应前 | 反应后 | |
烧杯与稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
160g | 10g | 166.7g |
(1)CaCO3中Ca元素的质量分数为____________。
(2)生成CO2的质量____________。
(3)求石灰石样品中碳酸钙的质量分数____________(写出计算过程)。
【题目】科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图所示)。
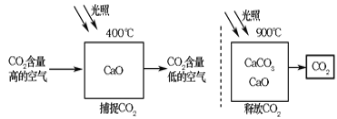
某化学小组的同学对此非常感兴趣,在老师的指导下,设计如下装置探究上述设想的反应原理是否可行。
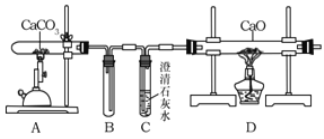
(1)能证明装置A“释放CO2”的现象是_____;
(2)装置B在实验结束撤掉酒精喷灯时的作用是_____;
(3)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2。
(猜想与假设)
D中的固体可能为:I.只有氧化钙;Ⅱ._____;Ⅲ.只有碳酸钙
(进行实验)
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立。乙同学认为上述实验不足以证明猜想Ⅲ成立,其原因是_____。
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是_____。
③丙同学认为乙同学的实验不够严谨,于是向白色固体中加入稀盐酸,再结合乙同学的结论完成下面的实验报告后,除猜想Ⅱ成立的结论。
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | 猜想Ⅱ成立 |
(4)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。该设想的优点有_____。
A 原料易得 B 充分利用太阳能 C 释放出的CO2可作为资源加以利用