题目内容
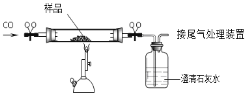
【题目】含杂质的Fe2O3固体样品20g,高温下用足量的CO完全还原(杂质不与CO反应),得剩余固体,并将生成的CO2气体用足量的澄清石灰水充分吸收后,产生30g白色沉淀.则下列说法不正确的是
A. 通入CO质量大于8.4g
B. 反应后剩余固体质量为11.2g
C. 样品中氧化铁的质量分数为80%
D. 样品中氧元素质量分数不一定为24%
【答案】C
【解析】
解:由Fe2O3+3CO![]() 2Fe+3CO2,CO2+Ca(OH)2=CaCO3↓+H2O,可得:Fe2O3---3CO---2Fe----3CaCO3
2Fe+3CO2,CO2+Ca(OH)2=CaCO3↓+H2O,可得:Fe2O3---3CO---2Fe----3CaCO3
160 84 112 300
16g 8.4g 11.2g 30g
A、理论上需要通入一氧化碳的质量为8.4g,但是在反应前后都需要通入一氧化碳,所以实际通入的CO质量大于8.4g,故A错误;
B、还原后铁的质量为11.2g,固体质量包括杂质质量,大于11.2g,故B错误;
C、样品中氧化铁的质量分数为:![]() ×100%=80%,故C正确;
×100%=80%,故C正确;
D、杂质中是否含有氧元素,不能确定,所以样品中氧元素质量分数可能为:![]() ×100%=24%,故D错误。
×100%=24%,故D错误。
故选:C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目