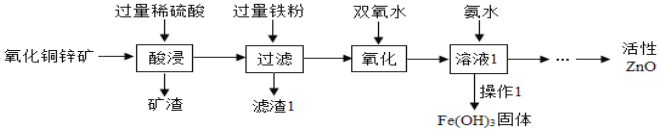
题目内容
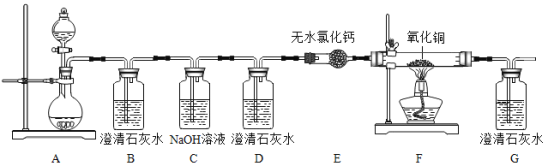
【题目】某研究性学习小组利用下列装置进行气体的制取,请分析并填空.
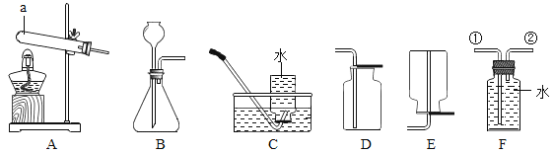
(1)写出图中仪器a的名称_____________;
(2)实验室用大理石和稀盐酸反应制取二氧化碳的化学方程为__________________________应选择的收集装置为__________________(填字母);
(3)若选择高锰酸钾制取O2,则应选择发生装置___________。该套装置有一处不足的地方,请你加以改进:______________________。若用盛满水的F装置收集氧气,氧气应从导管_____________(填①或②)处通入F装置.
(4)已知氨气(NH3)极易溶于水,实验室常用加热氢氧化钙和氯化铵的固体混合物制取氨气,化学方程式为2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O,制取氨气时,其发生装置应选________(填字母),收集方法应是_____________________。
CaCl2 + 2NH3↑ + 2H2O,制取氨气时,其发生装置应选________(填字母),收集方法应是_____________________。
【答案】试管 CaCO3+2HCl=CaCl2+CO2↑+H2O D A 试管口没有棉花团,应该放一团棉花 ② A E
【解析】
(1)据图可知仪器a的名称是试管;
(2)实验室制取CO2,是在常温下,用实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙、水和二氧化碳,化学方程为:CaCO3+2HCl=CaCl2+CO2↑+H2O,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;
(3)若选择高锰酸钾制取O2,则是固体加热型反应,应选择发生装置A;使用高锰酸钾制取氧气,需要在试管口塞一团棉花;若广口瓶充满水来收集氧气,则是排水法收集氧气,氧气的密度小于水,故应该从②端进入;
(4)加热氢氧化钙和氯化铵的固体混合物,因此需要加热;氨气(NH3)极易溶于水,密度比空气小,因此只能用向下排空气法收集氨气。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。
【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)