题目内容
【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)在空气中铝制品比铁制品更耐腐蚀的原因是:__________(化学方程式表示).
(2)某同学向氯化铜和氯化镁混合溶液中加入一定量的锌粉,待充分反应后过滤,向滤渣中滴加稀盐酸,有气体产生,则滤渣中一定含有______(填化学式),滤液中一定含有的溶质为______(填化学式)。
(3)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是______t(计算结果保留到0.1)。
(4)一定质量含杂质的铁(杂质不溶于水,也不参与反应)与100g16%硫酸铜溶液恰好完全反应,过滤得到干燥的固体6.8g,则含杂质的铁中的铁的质量分数是________(计算结果保留至0.1%)。
【答案】![]()
![]() 、
、![]()
![]() 、
、![]() 583.3 93.3%
583.3 93.3%
【解析】
(1)在空气中铝制品比铁制品更耐腐蚀的原因是:铝能和空气中的氧气反应生成一层致密的氧化铝薄膜,对里面的铝制品起到保护作用,反应的化学方程式为:4Al+3O2═2Al2O3.
故填:4Al+3O2═2Al2O3.
(2)镁比锌活泼,锌比铜活泼,向氯化铜和氯化镁混合溶液中加入一定量的锌粉时,锌不能和氯化镁反应,能和氯化铜反应生成氯化锌和铜,待充分反应后过滤,向滤渣中滴加稀盐酸,有气体产生,说明锌过量,则滤渣中一定含有Cu、Zn,滤液中一定含有的溶质为没有反应的氯化镁和反应生成的氯化锌.
故填:Cu、Zn;MgCl2、ZnCl2.
(3)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是:1000t×80%×![]() ×100%÷96%=583.3t.
×100%÷96%=583.3t.
故填:583.3.
(4)设铁的质量为x,生成铜的质量为y,
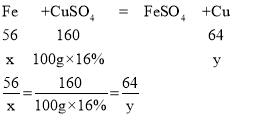
x=5.6g,y=6.4g,
铁中杂质质量为:6.8g-6.4g=0.4g,
则含杂质的铁中的铁的质量分数是:![]() ×100%≈93.3%,
×100%≈93.3%,
故填:93.3%.

 阅读快车系列答案
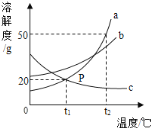
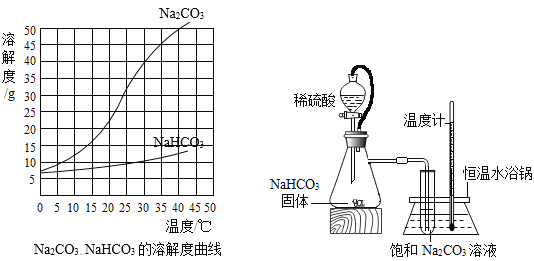
阅读快车系列答案【题目】由于溶解度不同(如图所示),饱和碳酸钠溶液中通入CO 2会析出碳酸氢钠晶体而使溶液变浑浊。某化学课外小组同学发现不同条件下出现浑浊的时间不同。
(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)碳酸氢钠晶体产生速率的影响因素有温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
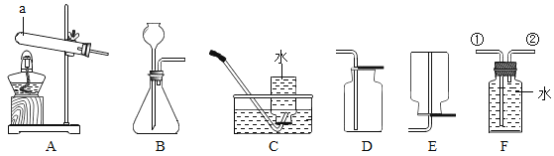
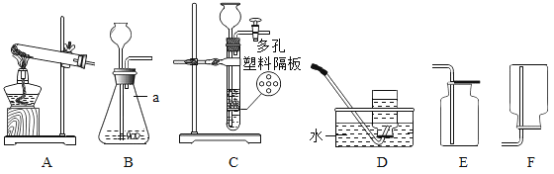
(进行实验)实验装置如图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并在试管后放置一张写有黑色字迹的白纸,从垂直于试管的方向观察白纸上字迹的清晰程度,记录时间,用于判断碳酸氢钠晶体的产生速率。部分实验记录如下表所示:
序号 | 温度(℃) | 试管内经(mm) | CO2流速 (个气泡/s) | 产生不同现象的时间(s) | ||
字迹变浅 | 字迹模糊 | 字迹消失 | ||||
① | 25 | 10 | 5~8 | 517" | 719" | 817" |
② | 32 | 10 | 5~8 | 350" | 409" | 428" |
③ | 40 | 10 | 5~8 | 348" | 406" | 418" |
④ | 25 | 14 | 5~8 | 636" | 738" | 828" |
⑤ | 25 | 25 | 5~8 | X | 943" | 1022" |
⑥ | 25 | 10 | 10~13 | 502" | 640" | 758" |
⑦ | 25 | 10 | 2~5 | 540" | 1045" | 1236" |
(解释与结论)
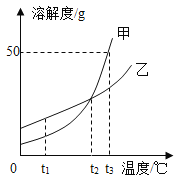
(1)由上述溶解度曲线图可知溶解度受温度影响相对更大的物质是_________________。
(2)锥形瓶中是利用碳酸氢钠与稀硫酸反应来制取二氧化碳。除生成二氧化碳外,还有水和硫酸钠生成,该反应的化学方程式为_____________________。
(3) 同学们若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有__________________。
(4)由实验①②③,可得出的结论是____________________。
(5)实验①④⑤研究的影响因素是___________________。
(6)通过对数据的观察和分析,小倩认为“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”,得到该结论的依据是______________(填实验序号)。
(反思与评价)
(7)表中X的取值范围应该是_______________。
(8)该实验采用硫酸而不是盐酸来制备二氧化碳的原因是__________________。
(9)如图中使用橡皮管连接分液漏斗与锥形瓶的目的是__________________。
(10)如何除去碳酸钠中混有的少量碳酸氢钠?___________________。
【题目】水是人类宝贵的自然资源。
(1)判断生活用水是硬水还是软水,可加入_________进行检验。
(2)下列净化水的单一操作中,相对净化程度较高的是_________(填字母)。
A 静置沉淀 B 吸附沉淀 C 蒸馏 D 过滤
(3)在电解水实验中,正负极产生的气体体积比约为_________。
(4)![]() 和
和![]() 在不同温度时的溶解度如下表所示。
在不同温度时的溶解度如下表所示。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g |
| 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
| 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 4.55 | 48.3 | 51.1 | |
请回答下列问题:
①依据上表数据,绘制![]() 和
和![]() 的溶解度曲线,如图中能表示
的溶解度曲线,如图中能表示![]() 溶解度曲线的是__________(填“m”或“n”)。
溶解度曲线的是__________(填“m”或“n”)。

②由表中数据分析可知,![]() 和
和![]() 在某一温度时具有相同的溶解度x,则x的取值范围是__________。
在某一温度时具有相同的溶解度x,则x的取值范围是__________。
③现有40℃时等质量的硝酸钾、氯化钾饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾溶液__________氯化钾溶液(填“>”、“<”或“=”)。
A是80℃含有120g水的![]() 溶液,经过如下操作,得到102g
溶液,经过如下操作,得到102g![]() 固体。
固体。

下列对以上过程的分析,正确的是_________(填字母编号)
a A到B的过程中,溶质质量没有改变 b B中溶质与溶剂的质量比为169:100
c 开始析出![]() 固体的温度在60℃至70℃之间 d A溶液的质量等于222g
固体的温度在60℃至70℃之间 d A溶液的质量等于222g