题目内容
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:
①反应I是粗盐除杂;
②反应II是特殊条件下电解NaCl溶液制NaClO3;
③反应Ⅲ是ClO2的制取。其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。
工艺流程如图,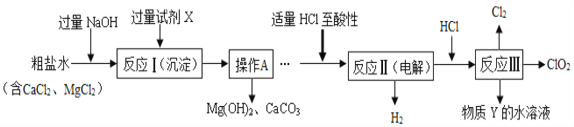
(1)加入过量氢氧化钠的目的是__________________________。
(2)过量的试剂X是_______(填化学式),操作A的名称是_____________。
(3)写出反应I中的一个反应方程式______________________________。
(4)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,请写出其中所发生的中和反应的化学方程式:_____________。
(5)该流程中可循环利用的物质是水和___________。
【答案】 除尽氯化镁杂质 Na2CO3 过滤 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl HCl+NaOH=NaCl+H2O NaCl
【解析】(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入过量氢氧化钠的目的是除尽氯化镁杂质,(2)由操作A得到的沉淀有碳酸钙,可知过量的试剂X是Na2CO3,和氯化钙反应生成碳酸钙沉淀和氯化钠,操作A的作用是将难溶性固体与液体分离,名称是过滤;(3)反应I中的反应方程式Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl; (4)在除杂过程中,溶液中引入了氢氧化钠和碳酸钠杂质,加入适量HCl能将氢氧化钠和碳酸钠转化成氯化钠达到除杂的目的,其中氢氧化钠和盐酸发生的是中和反应,反应的化学方程式:HCl+NaOH=NaCl+H2O;(5)该流程中可循环利用的物质是水和NaCl。