题目内容
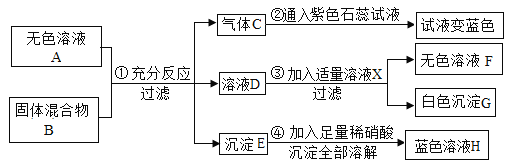
【题目】硝酸钾固体与氯化钾固体的溶解度曲线如下图所示,回答下列问题:
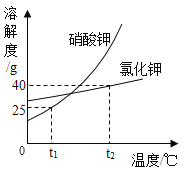
(1)![]() ℃时,两种物质中溶解度较大的是_____。
℃时,两种物质中溶解度较大的是_____。
(2)![]() ℃时,两种物质的等质量饱和溶液降温至
℃时,两种物质的等质量饱和溶液降温至![]() ℃,析出固体质量较多的是_____的溶液。
℃,析出固体质量较多的是_____的溶液。
(3)![]() ℃时,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,所得溶液为_____(填“饱和”或“不饱和”)溶液,该溶液中所含的大量离子,其符号是_____。
℃时,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,所得溶液为_____(填“饱和”或“不饱和”)溶液,该溶液中所含的大量离子,其符号是_____。
(4)欲配制溶质质量分数为20%的硝酸钾溶液,应满足的温度范围:_____。
【答案】氯化钾 硝酸钾 饱和 K+、NO3- 温度不低于t1℃
【解析】
(1)由溶解度曲线可知:t1℃时,两种物质中溶解度较大的是氯化钾;;
(2)t2℃时,两种物质的等质量饱和溶液降温至t1℃时,析出固体质量较多的是硝酸钾,因为硝酸钾的溶解度随温度的升高变化比氯化钾大;
(3)t2℃时,氯化钾的溶解度是40g,根据溶解度概念可知,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,最多只能溶解20g,得到氯化钾的饱和溶液;硝酸钾在水溶液中能离解出钾离子和硝酸根离子,离子符号分别为:K+、NO3-;
(4)由溶解度曲线可知:t1℃,硝酸钾的溶解度是25g,形成饱和溶液的溶质质量分数=![]() 。欲配制溶质质量分数为20%的硝酸钾溶液,应满足的温度范围是:温度不低于t1℃。
。欲配制溶质质量分数为20%的硝酸钾溶液,应满足的温度范围是:温度不低于t1℃。

 发散思维新课堂系列答案
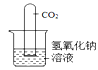
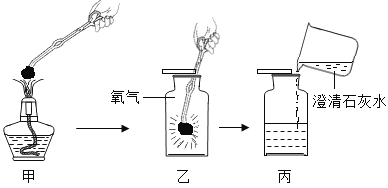
发散思维新课堂系列答案【题目】实验室用石灰水而不用氢氧化钠溶液鉴定二氧化碳。氢氧化钠能否与二氧化碳反应?
(查阅资料)(1).氢氧化钠溶液与二氧化碳反应生成易溶的碳酸钠,碳酸钠在二氧化碳过量的条件下继续与水和二氧化碳反应生成碳酸氢钠
(2).碳酸钠和碳酸氢钠性质对比如下表
操作 | NaHCO3溶液 | Na2CO3溶液 |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入稀CaCl2溶液 | 无明显变化 | __________________(填写现象) |
加热溶液至沸腾,并将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(进行实验)
实验操作 | 化学方程式 | 结论及实验现象 |
| ____________ | 氢氧化钠与二氧化碳反应生成碳酸钠,写出该反应化学方程式:_________________ |
(实验反思)学习小组同学经过分析讨论,认为产生此实验现象的原因可能有两种:
一种是NaOH与CO2发生了反应; 另一种是_______________________
(2) 为了进一步验证CO2与NaOH溶液已经发生反应,请你设计一个简单的实验检验生成的新物质。
实验步骤 | 实验现象 | 解释与结论 |
_________ | _____________ | NaOH与CO2发生了反应 |
(实验拓展)该小组同学将二氧化碳通入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,待完全反应后,观察到溶液中逸出大量气泡,pH出现两段S型变化曲线。
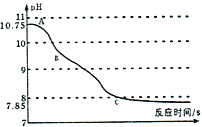
(实验分析)
(3)AB段变化的原因可能是______________。
BC段变化的原因可能是______________。
实验操作为________________。
实验现象是_________________。