题目内容
【题目】为减少温室气体的排放,人们积极寻找不含碳元素的燃料。经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景,其微观过程如图所示。下列有关说法正确的是( )
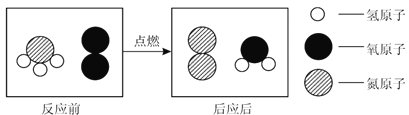
A.该化学反应遵循质量守恒定律B.参加反应的两种物质分子个数比为1:1
C.反应后氧元素的化合价升高D.反应后生成的两种物质均为化合物
【答案】A
【解析】
由反应的结构示意图和模型表示的原子种类,可判断该反应的化学方程式为:4NH3+3O2![]() 2N2+6H2O。
2N2+6H2O。
A、所有的化学反应都遵循质量守恒定律,故正确;
B、由方程式可知,参加反应的两物质分子个数比为4:3,故错误;
C、由方程式可知,氧元素的化合价不变,故错误;
D、由方程式可知,反应后生成物一种为化合物,一种为单质,故错误。
故选A。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
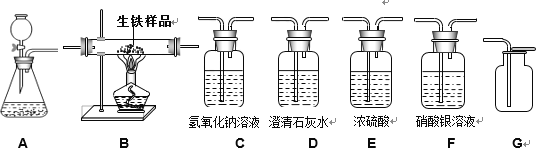
(问题讨论)为了测定铁红中铁元素的质量分数,小组间学进行如下实验。(装置气密性良好)

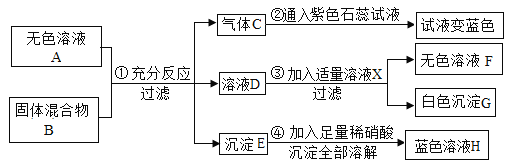
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)写出E装置中所发生反应的一个化学方程式:_____。
(3)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则_____<m<_____。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是_____。
(实验反思)
(4)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(5)该实验装置的一个明显缺陷是_____。
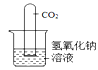
【题目】实验室用石灰水而不用氢氧化钠溶液鉴定二氧化碳。氢氧化钠能否与二氧化碳反应?
(查阅资料)(1).氢氧化钠溶液与二氧化碳反应生成易溶的碳酸钠,碳酸钠在二氧化碳过量的条件下继续与水和二氧化碳反应生成碳酸氢钠
(2).碳酸钠和碳酸氢钠性质对比如下表
操作 | NaHCO3溶液 | Na2CO3溶液 |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入稀CaCl2溶液 | 无明显变化 | __________________(填写现象) |
加热溶液至沸腾,并将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(进行实验)
实验操作 | 化学方程式 | 结论及实验现象 |
| ____________ | 氢氧化钠与二氧化碳反应生成碳酸钠,写出该反应化学方程式:_________________ |
(实验反思)学习小组同学经过分析讨论,认为产生此实验现象的原因可能有两种:
一种是NaOH与CO2发生了反应; 另一种是_______________________
(2) 为了进一步验证CO2与NaOH溶液已经发生反应,请你设计一个简单的实验检验生成的新物质。
实验步骤 | 实验现象 | 解释与结论 |
_________ | _____________ | NaOH与CO2发生了反应 |
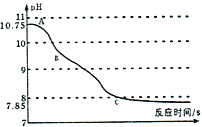
(实验拓展)该小组同学将二氧化碳通入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,待完全反应后,观察到溶液中逸出大量气泡,pH出现两段S型变化曲线。
(实验分析)
(3)AB段变化的原因可能是______________。
BC段变化的原因可能是______________。
实验操作为________________。
实验现象是_________________。