题目内容
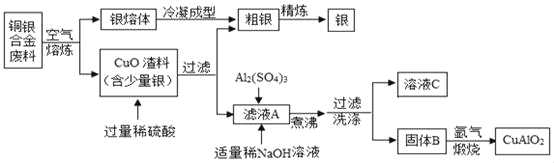
【题目】银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程。
(资料)
Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化,银在空气中不易被氧化。
请回答下列问题:
(1)可将铜丝浸入__________溶液中来验证铜、银两种金属的活动性强弱。
(2)固体B在煅烧时发生的其中一个反应方程式为4CuO+2Al2O3![]() 4CuAlO2+X↑,气体X的化学式为___________,CuAlO2中铜元素的化合价为__________。
4CuAlO2+X↑,气体X的化学式为___________,CuAlO2中铜元素的化合价为__________。
(3)煮沸过程中发生反应的化学方程式为__________。
(4)“煅烧”时温度须控制在1042﹣1085℃范围内且在氩气中进行,其原因是__________。
【答案】AgNO3;O2;+1;Cu(OH)2![]() CuO+H2O;防止温度过高CuAlO2分解和氧化。
CuO+H2O;防止温度过高CuAlO2分解和氧化。
【解析】
(1)要证明铜和银的活动性强弱,可以将铜丝浸入到硝酸银溶液中,如有银析出,说明铜比银活泼。
(2)4CuO+2Al2O3![]() 4CuAlO2+X↑,反应前含有4个Cu原子,10个O原子,4个Al原子,反应后含有4个Cu原子,4个Al原子,8个O原子,故X中含有2个O原子,其化学式为O2,设CuAlO2中铜元素的化合价为x,则有:x+(+3)+(﹣2)×2=0,x=+1。
4CuAlO2+X↑,反应前含有4个Cu原子,10个O原子,4个Al原子,反应后含有4个Cu原子,4个Al原子,8个O原子,故X中含有2个O原子,其化学式为O2,设CuAlO2中铜元素的化合价为x,则有:x+(+3)+(﹣2)×2=0,x=+1。
(3)氧化铜和硫酸反应生成硫酸铜和水,故得到的滤液A中含有硫酸铜和剩余的硫酸,加入氢氧化钠溶液和硫酸铝溶液,则氢氧化钠会与硫酸反应生成硫酸钠和水,氢氧化钠会与硫酸铜反应生成氢氧化铜,与硫酸铝反应生成氢氧化铝,煮沸则温度最高达到100℃,由于Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃故煮沸时发生的反应是氢氧化铜的分解反应,反应方程式为Cu(OH)2![]() CuO+H2O;
CuO+H2O;
(4)由于CuAlO2高温易分解、受热易氧化,故“煅烧”时温度须控制在1042﹣1085℃范围内且在氩气中进行,是为了防止温度过高CuAlO2分解和氧化。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
(提出问题)①三种溶液的酸碱性?②它们与酸反应时溶液的pH如何变化?
(查阅资料)
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
(实验1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
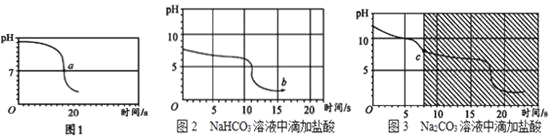
(实验2)向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
(实验3)向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。
(解释与结论)
(1)实验1得出三种溶液中碱性最强的为______________溶液。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是______________,该反应的化学方程式为______________。若取出少量a点的溶液,向其中滴加紫甘蓝汁液,观察到的现象是______________。
(3)实验3中,b点的溶质为______________,实验3中,c点后发生反应的化学方程式为_____________。
(4)依据实验3,加入足量的盐酸,产生二氧化碳的量______________。
A.碳酸氢钠多 B.碳酸钠多
C.两者一样多 D.不能确定哪个多