题目内容
据央视报道:2013年6月10日上午我国自行研制的“蛟龙”号潜艇,承载14位科学家再次深海科学考察.潜水艇中可用过氧化钠Na2O3作供氧剂,净化室内空气.为探究其反应原理,某学习小组学生在老师指导下,进行了如下探究实验,请你参与并回答下列问题:
【查阅资料】
过氧化钠常温下能与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气.
(1)请写出过氧化钠与水反应的化学方程式 .
【实验设计】
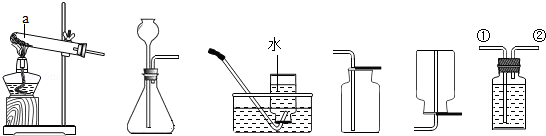
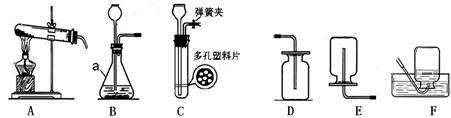
为探究二氧化碳与过氧化钠的反应,并验证反应产物.选用如图仪器和如图实验装置.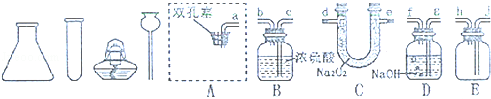
(2)用A处做二氧化碳的发生装置,装配该装置时,应选用的仪器除带导管的双孔塞外,还需要上述的仪器有 , (填名称).写出制取二氧化碳气体的化学方程式 .
(3)为了体现CO2与过氧化钠反应,且E中只收集到氧气一种气体,请选用适当的实验装置,填写装置导气管的连接顺序是a→ → →d→e→ → →j.
【实验验证】
(4)用 ,证明装置E中收集的气体是氧气.
(5)检验装置C中反应后剩余固体物质的成分:
①取少量C中反应后的固体于试管中,滴加少量的 ,观察到 的实验现象,说明含有过氧化钠.
②再向试管的溶液中,滴加 ,观察到 的实验现象,说明装置C反应后生成碳酸钠.
(1)2Na2O2+2H2O═4NaOH+O2↑;
(2)长颈漏斗;锥形瓶;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)c;b;g;f;
(4)用带火星的木条放在h管口,若发现木条复燃;
(5)①蒸馏水;有气泡冒出;
②适量的氯化钙溶液;有白色沉淀产生.
解析试题分析:(1)根据题中信息可以知道,过氧化钠常温下能与水反应生成氢氧化钠和氧气,该反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑;
(2)制取二氧化碳的发生装置所需的仪器除了A中的装置外,还需要长颈漏斗和锥形瓶,其反应原理为碳酸钙和稀盐酸反应,该反应生成了二氧化碳、水和氯化钙,该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)为了防止生成二氧化碳时带出的水蒸气影响实验所以应该先进行干燥,然后再通过过氧化钠固体,然后通过氢氧化钠溶液来除去二氧化碳,从而得到比较纯净的氧气,所以正确的连接顺序为:a→c→b→d→e→g→f→j;
(4)氧气具有助燃性,能够使带火星的木条复燃,所以可以用带火星的木条放在h管口来检验是否为氧气,若观察到木条复燃则说明收集满了;
(5)①过氧化钠能够和水反应生成氧气,所以可以用水来检验,其操作为:取少量C中反应后的固体于试管中,滴加少量的蒸馏水,若观察到有气泡冒出的实验现象,说明含有过氧化钠;
②碳酸钠能够和氯化钙溶液反应生成沉淀,所以向实验①试管中所得的溶液,滴加适量的氯化钙溶液,若观察到有白色沉淀产生,则说明装置C反应后生成碳酸钠.
考点:制取气体的反应原理的探究;常见气体的检验与除杂方法;证明碳酸盐;氧气的检验和验满;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
点评:该题根据查阅资料提供的信息并结合实验步骤和现象解决问题.主要考查读题能力,能把题目所给信息与所学知识进行牵连.知道性质决定用途,用途体现性质.

下列实验中,所用试剂或方法正确的是
| A.除去CaO中少量CaCO3:加入适量盐酸后过滤 |
| B.证明碳酸钠溶液中含氢氧化钠:加过量氯化钙溶液后加酚酞,观察是否变红 |
| C.检验集气瓶中的氧气已收满:将带火星的木条插到集气瓶底部,观察木条是否立刻剧烈燃烧 |
| D.测定某溶液的酸碱度:取少量样品,滴加紫色石蕊试液 |
以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是( )
| A.Fe3+ SO42﹣ H+ Cl﹣ | B.Mg2+ Cl﹣ OH﹣ Na+ |
| C.H+ Ba2+ NO3﹣ SO42﹣ | D.H+ Na+ K+ NO3+ |
下列实验中,根据有关现象得出结论,合理的是()
| | 实验操作 | 现象 | 结论 |
| A | 向盛有少量无色溶液的试管中滴.加酚酞试液 | 溶液变红 | 该溶液一定呈碱性 |
| B | 向盛有少量无色溶液的试管中滴 加氯化钡溶液 | 出现白色沉淀 | 该溶液中一定含有硫酸根离子 |
| C | 向盛有少量固体的试管中滴加稀 盐酸 | 产生气泡 | 该固体一定含有碳酸盐 |
| D | 点燃某气体,在火焰上方罩一个 干冷的烧杯 | 烧杯内壁出现水珠 | 该气体一定是氢气 |