题目内容
【题目】甲、乙两个化学研究小组的同学对生活中的一些金属材料进行了一系列的研究。
Ι.甲组同学收集了一些废铜屑。他们欲用这些废铜屑制取硫酸铜,设计了如下两个方案:
方案1:Cu![]() CuO
CuO![]() CuSO4
CuSO4
方案2:Cu![]() CuSO4[已知Cu+2H2SO4(浓)
CuSO4[已知Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O]
CuSO4+SO2↑+2H2O]
从绿色化学的观点出发,上述两个方案中,你认为比较合理的是_____方案(填“1”或“2”)。
Ⅱ.乙组同学还利用单质铜制取氢氧化铜。设计方案如图1:
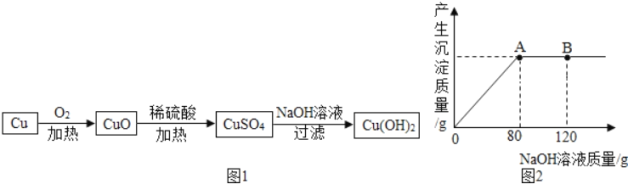
(1)铜加热转化为氧化铜的化学反应,属于_____反应类型(填“化合”、“分解”、“置换”之一)。
(2)取一定量的氧化铜放入盛有一定量稀硫酸的烧杯中,恰好完全反应。向烧杯中逐滴加入 10%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系曲线如图2所示。
① 滴入上述NaOH溶液至 B 点时,溶液中溶质是_____。
② 当滴入上述NaOH溶液至 A 点时,试通过计算,所得氢氧化铜沉淀的质量_____。(计算结果精确至 0.1g)
【答案】1 化合 Na2SO4、NaOH 9.8g
【解析】
Ι.方案1:Cu![]() CuO
CuO![]() CuSO4,方案1没有明显的有毒性、污染性气体产生,原料利用率高;
CuSO4,方案1没有明显的有毒性、污染性气体产生,原料利用率高;
方案2:Cu![]() CuSO4[已知Cu+2H2SO4(浓)
CuSO4[已知Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O],根据给出的转化关系可知生成二氧化硫,同时消耗的硫酸也多,所以从绿色化学的观点出发,上述两个方案中,比较合理的是方案1,故填1。
CuSO4+SO2↑+2H2O],根据给出的转化关系可知生成二氧化硫,同时消耗的硫酸也多,所以从绿色化学的观点出发,上述两个方案中,比较合理的是方案1,故填1。
Ⅱ.(1)铜加热转化为氧化铜的化学反应,是两种物质反应生成一种物质,符合化合反应的特征,属于化合反应,故填化合。
(2)①由图可知,滴入上述NaOH溶液至 A点沉淀达到最大量,此时硫酸铜与氢氧化钠恰好完全反应,所以至B点时氢氧化钠有剩余,此时的溶液中溶质是生成的Na2SO4和剩余的NaOH,故填Na2SO4和NaOH。
②解:参加反应的氢氧化钠的质量为80g×10%=8g
设Cu(OH)2沉淀的质量为x
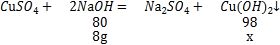
80:98=8g:x
x=9.8g
答:所得氢氧化铜沉淀的质量为9.8g。

 口算能手系列答案
口算能手系列答案