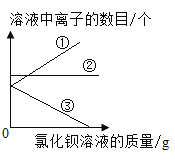
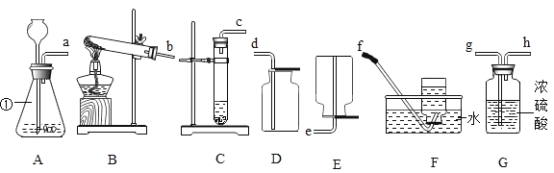
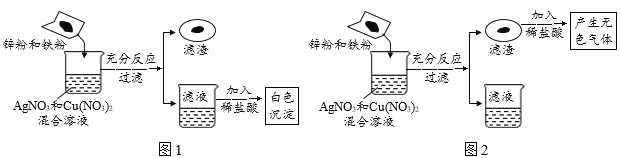
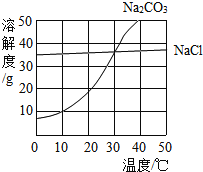
题目内容
【题目】已知碳酸钙在高温煅烧时会分解生成氧化钙和二氧化碳,该反应的化学方程式为_______________________;反应一段时间后,测得CaCO3和CaO的固体混合物中Ca与C的质量比为10:1,则该混合物中 Ca 与O的质量比为____。
【答案】CaCO3![]() CaO+CO2↑ 3:2
CaO+CO2↑ 3:2
【解析】
碳酸钙在高温条件下反应生成氧化钙和二氧化碳,故反应的化学方程式写为:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。
设碳元素质量为12克,则根据Ca与C的质量比是10:1可知混合物中钙元素的总质量为120g,CaCO3中Ca与C质量比是40:12,所以CaCO3中Ca的质量为40g,CaCO3中C和O的质量比是12:48,所以CaCO3中O的质量是48g,CaO中Ca的质量为120g-40g=80克, CaO中Ca与O的质量比是40:16,根据80gCa可计算出氧化钙中O的质量是32g,混合物中O的质量和=48克+32克=80克,所以混合物中Ca元素与O元素的质量比=120克:80克=3:2,故填3:2。

练习册系列答案
相关题目