题目内容
【题目】童童同学在学习完酸、碱、盐的化学性质后,做了如下实验:
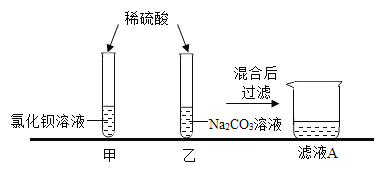
[观察与讨论]甲实验时观察到了______________现象。
童童同学将甲、乙实验后废液混合起来对废液进行处理,混合过程中产生气泡,过滤,得到滤液A,则产生气泡一定发生反应的化学反应方程式为______________。
[提出问题] :滤液A中的含有哪些离子?
[猜想与假设] :婷婷同学猜想: Na+、CI-
童童同学猜想: Na+、CI-、CO32-、SO42-
希溪同学猜想: Na+、CI-、Ba2+、H+
[实验与探究] :为得出有关滤液成分的准确结论,他们进行了如下探究,其现象和结论如下:
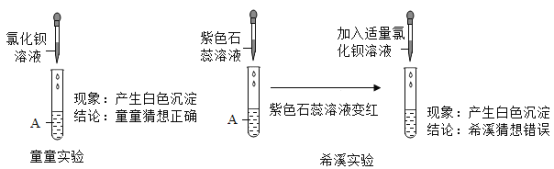
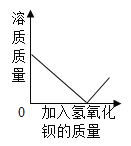
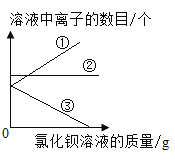
[评价交流]请对童童同学由实验现象得出的结论给予评价________________;根据希溪同学的实验现象及综合分析,最终可以得出滤液中含有的离子是______________(填符号) ;在加入适量的氯化钡溶液过程中滤液A的离子变化情况如图所示,①和③分别表示的是__________(填符号) ;
[归纳总结]通过以上实验我们能够总结出,在研究反应后溶液中离子成分时,首先应该根据实验中出现的现象判断出_____________的离子,如果溶液中含有多种需要待测定的离子时,应该选择一种_______的试剂,根据现象确定溶液中的离子成分.
【答案】溶液中产生白色沉淀 ![]() 不正确,在溶液中硫酸根离子和碳酸根离子均能与钡离子反应生成白色沉淀,加入氯化钡溶液产生白色沉淀,说明溶液中含有硫酸根离子和碳酸根离子中的一种或两种,不能证明溶液中同时含有硫酸根离子和碳酸根离子,所以不正确;或不正确,若溶液中离子是钠离子、氯离子和硫酸根离子,加入氯化钡溶液,在溶液中硫酸根离子与钡离子反应生成硫酸钡也产生白色沉淀,所以不正确(合理即可) Na+、 C1-、 H+、SO42+ C1-、SO42+ 一定存在 与多种离子反应产生不同的(明显)实验现象
不正确,在溶液中硫酸根离子和碳酸根离子均能与钡离子反应生成白色沉淀,加入氯化钡溶液产生白色沉淀,说明溶液中含有硫酸根离子和碳酸根离子中的一种或两种,不能证明溶液中同时含有硫酸根离子和碳酸根离子,所以不正确;或不正确,若溶液中离子是钠离子、氯离子和硫酸根离子,加入氯化钡溶液,在溶液中硫酸根离子与钡离子反应生成硫酸钡也产生白色沉淀,所以不正确(合理即可) Na+、 C1-、 H+、SO42+ C1-、SO42+ 一定存在 与多种离子反应产生不同的(明显)实验现象
【解析】
[观察与讨论]
甲实验时,氯化钡溶液与稀硫酸反应生成硫酸钡白色沉淀和盐酸,故观察到了溶液中产生白色沉淀现象。
将甲、乙实验后废液混合起来对废液进行处理,混合过程中产生气泡,过滤,得到滤液A,则产生气泡一定发生反应是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学反应方程式为![]() 。
。
[评价交流]
童童同学由实验现象得出的结论不正确,在溶液中硫酸根离子和碳酸根离子均能与钡离子反应生成白色沉淀,加入氯化钡溶液产生白色沉淀,说明溶液中含有硫酸根离子和碳酸根离子中的一种或两种,不能证明溶液中同时含有硫酸根离子和碳酸根离子,所以不正确;或不正确,若溶液中离子是钠离子、氯离子和硫酸根离子,加入氯化钡溶液,在溶液中硫酸根离子与钡离子反应生成硫酸钡也产生白色沉淀,所以不正确(合理即可);
根据希溪同学的实验现象及综合分析,溶液含H+,综合童童实验,可知溶液含SO42+,溶液肯定有氯化钠,最终可以得出滤液中含有的离子是Na+、 C1-、 H+、SO42+;
在加入适量的氯化钡溶液过程中滤液A的离子变化情况为:硫酸根离子转化为沉淀变小,氢离子不变,氯离子逐渐增多,故①和③分别表示的是C1-、SO42+;
[归纳总结]
通过以上实验我们能够总结出,在研究反应后溶液中离子成分时,首先应该根据实验中出现的现象判断出一定存在的离子,如果溶液中含有多种需要待测定的离子时,应该选择一种与多种离子反应产生不同的(明显)实验现象的试剂,根据现象确定溶液中的离子成分。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案