题目内容
碱石灰是实验室常用的干燥剂.[提出问题]
实验室中久置的碱石灰样品的成分是什么?
[进行猜想]
久置的碱石灰样品中可能含有CaO、NaOH、
Ca(OH)2、Na2CO3、CaCO3等成分.样品中可能含有Ca(OH)2、Na2CO3的原因是(用化学方程式表示)______、______.
[实验过程]

试回答下列问题:
(1)操作①的名称是______.溶液C中加入酚酞的现象I为______.
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有______,反应的方程式为______.
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是______.
[实验结论]该久置的碱石灰样品中能确定一定含有的物质是______.(填序号)
A、CaO B、NaOH C、Ca(OH)2 D、Na2CO3 E、CaCO3.

【答案】分析:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.
[实验过程]
(1)浊液分离成固体B和溶液C,过滤的使用范围就是把不溶性固体和液体分离,酚酞遇碱变红.
(2)根据物质的组成可知,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
[实验结论]根据流程图分析,判断哪些是肯定存在,哪些是可能.
解答:解:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2,2NaOH+CO2═Na2CO3.
[实验过程]
(1)浊液分离成固体B和溶液C,不溶性固体和液体分离符合过滤的使用范围;根据酸碱指示剂的变色范围可知,酚酞遇碱变红.故答案为:过滤,酚酞溶液变红.
(2)根据物质的组成可知,只有碳酸钠可以和氯化钙反应生成碳酸钙沉淀.故答案为:碳酸钠,Na2CO3+CaCl2═2NaCl+CaCO3↓.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.故答案为:取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成.
[实验结论]样品溶于水后,烧杯内壁发热,说明有氧化钙或者是氢氧化钠,氧化钙和水反应放出较多热量,氢氧化钠是溶解放热;过滤得到固体B,说明B是碳酸钙(这个碳酸钙可能是氧化钙与二氧化碳反应的结果,也包含氢氧化钠变质后的碳酸钠与氢氧化钙反应的结果;溶液A中加入氯化钙生成碳酸钙沉淀,说明含有碳酸钠;由于加入了过量的氯化钙溶液,所以在溶液C中无碳酸钠剩余,当酚酞呈现红色时说明有碱性物质存在,由于加入的氯化钙对应沉淀,所以A中无氢氧化钙溶液,所以C处只能是氢氧化钠存在.由于碳酸钙存在,所以E也在选择范围中.则原混合物中一定含有碳酸钠和氢氧化钠和碳酸钙.故答案为:BDE.
点评:[实验结论]不好处理,做题时要前后对照,因果要清楚,酚酞变红的因素较多,比如氧化钙、氢氧化钠、氢氧化钙等.
[实验过程]
(1)浊液分离成固体B和溶液C,过滤的使用范围就是把不溶性固体和液体分离,酚酞遇碱变红.
(2)根据物质的组成可知,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
[实验结论]根据流程图分析,判断哪些是肯定存在,哪些是可能.
解答:解:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2,2NaOH+CO2═Na2CO3.
[实验过程]
(1)浊液分离成固体B和溶液C,不溶性固体和液体分离符合过滤的使用范围;根据酸碱指示剂的变色范围可知,酚酞遇碱变红.故答案为:过滤,酚酞溶液变红.
(2)根据物质的组成可知,只有碳酸钠可以和氯化钙反应生成碳酸钙沉淀.故答案为:碳酸钠,Na2CO3+CaCl2═2NaCl+CaCO3↓.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.故答案为:取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成.
[实验结论]样品溶于水后,烧杯内壁发热,说明有氧化钙或者是氢氧化钠,氧化钙和水反应放出较多热量,氢氧化钠是溶解放热;过滤得到固体B,说明B是碳酸钙(这个碳酸钙可能是氧化钙与二氧化碳反应的结果,也包含氢氧化钠变质后的碳酸钠与氢氧化钙反应的结果;溶液A中加入氯化钙生成碳酸钙沉淀,说明含有碳酸钠;由于加入了过量的氯化钙溶液,所以在溶液C中无碳酸钠剩余,当酚酞呈现红色时说明有碱性物质存在,由于加入的氯化钙对应沉淀,所以A中无氢氧化钙溶液,所以C处只能是氢氧化钠存在.由于碳酸钙存在,所以E也在选择范围中.则原混合物中一定含有碳酸钠和氢氧化钠和碳酸钙.故答案为:BDE.
点评:[实验结论]不好处理,做题时要前后对照,因果要清楚,酚酞变红的因素较多,比如氧化钙、氢氧化钠、氢氧化钙等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
 33、碱石灰是实验室常用的干燥剂.
33、碱石灰是实验室常用的干燥剂.
 碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究.
碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究. 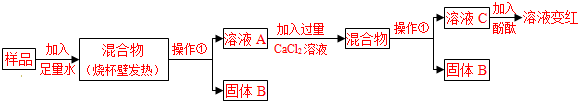

 该反应属于 (10) (填写基本反应类型), 根据质量守恒定律,可以推知产物中“铁的氧化物”的化学式是 (11) 。
该反应属于 (10) (填写基本反应类型), 根据质量守恒定律,可以推知产物中“铁的氧化物”的化学式是 (11) 。
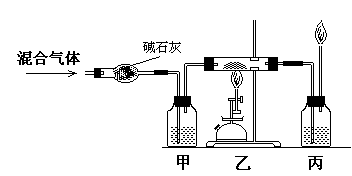
 (17) ,该反应中还原剂是 (18) 。 甲、丙两处所盛放的试液分
(17) ,该反应中还原剂是 (18) 。 甲、丙两处所盛放的试液分