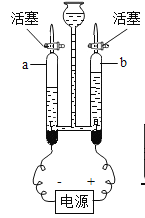
题目内容
【题目】下列实验操作错误的是( )
A. 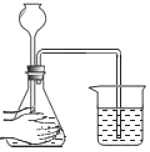 检查气密性B.
检查气密性B. 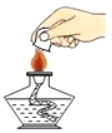 熄灭酒精灯
熄灭酒精灯
C. 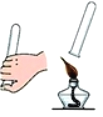 检验氢气的纯度D.
检验氢气的纯度D. 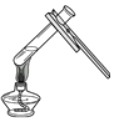 加热液体
加热液体
【答案】A
【解析】
A、检查装置气密性的方法:把导管的一端浸没在水里,用手紧贴试管外壁,若导管口有气泡冒出,装置不漏气,图中长颈漏斗与外界相通,无法检测,图中所示操作错误;
B、使用酒精灯时要注意“两查、两禁、一不可”,熄灭酒精灯要用灯帽盖灭,不能用嘴吹灭,图中所示操作正确;
C、检验氢气纯度的方法:用排水法收集一试管氢气,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指点火,如果听到尖锐的爆鸣声,表明氢气不纯,需要再收集,再检验,直到听到很小的响声,才表明氢气已经纯净,图中所示操作正确;
D、给液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的三分之一,图中所示操作正确。
故选A。

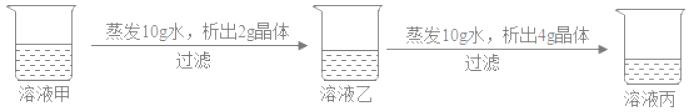
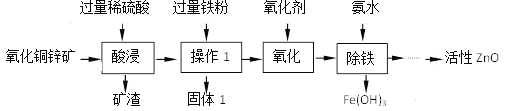
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。
【题目】课外实验:“叶脉书签”(如图)的制作过程是将洗干净的树叶放在一定浓度的氢氧化钠溶液中煮沸,再加以处理,除去表皮和叶肉,只余清晰的叶脉,就能得到“叶脉书签”。实验小组同学进行了氢氧化钠溶液的配制及叶脉书签的制作。

(1)配制100g10%的氢氧化钠溶液。下列步骤有错误的是:________(填字母序号)。
A、计算:计算需氢氧化钠的质量为10g,水的体积为100mL。
B、称量:在托盘天平的左右两个托盘上各放一张大小相同的纸片,称量10g氢氧化钠放入烧杯,
C、量取:用量筒量取水倒入盛有氢氧化钠的烧杯中
D、溶解:用玻璃棒搅拌溶解
(2)某位同学做完实验以后,老师认为该学生的溶液浓度小于10%,你认为可能是下列哪一种原因造成的______(填字母序号)。
A、称量10g氢氧化钠时间过长。
B、用量筒量取液体时俯视量取。
C、溶解过程中玻璃棒搅拌时造成液滴飞溅
(3)实验小组又配制了1%和5%的氢氧化钠溶液
(4)探究制作“叶脉书签”的最佳条件
实验1:相同煮沸时间内,将树叶放在不同浓度的氢氧化钠溶液里,处理后叶片变化如下表。
NaOH溶液浓度 | 1% | 5% | 10% |
叶片变化 | 留有很多叶肉 | 留有较多叶肉 | 残留很少叶肉 |
实验2:在10%的氢氧化钠溶液里,将树叶进行不同时间的煮沸,处理后叶片变化如下表。
煮沸时间 | 5min | 15min | 20min |
叶片变化 | 留有较多叶肉 | 残留很少叶肉 | 叶片卷起来,叶肉与叶脉不易分离 |
①实验1的实验目的是___________。
②通过实验1、2可知,制作“叶脉书签”的最佳条件是_____(填字母序号)。
A.1%、5min B.5%、15min C.10%、20min D.10%、15min
(5)废液的处理:氢氧化钠溶液不能直接倒入下水道,会造成水资源的污染,合理的做法是将废液收集起来,并____________ 。
【题目】下表是几种家用清洁剂的功能和有效成分。
清洁剂 |
洁厕灵 |
彩漂液 |
漂白水 |
功能 | 清除污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 漂出衣物污渍 |
有效成分 | HCl | H2O2 | NaClO |
根据表中信息,回答下列问题。
(1)大理石上的污垢不能用“洁厕灵”清洁的理由是____________。
(2)在盛有少量“彩漂液”的试管中,加少量二氧化锰,观察到的现象是____________。
(3)“洁厕灵”与“漂白水”不能混用。二者若混合其有效成分之间能发生化学反应,产生氯化钠、水和有毒的氯气(C12),化学方程式为____________。
【题目】某同学为了测定实验室中氯酸钾样品的纯度,取10g该样品与1g二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 10.04 | 9.08 | 8.12 | 8.12 |
(1)完全反应后产生氧气的质量为_____________。
(2)求该样品中氯酸钾的纯度________。