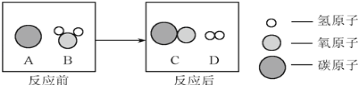
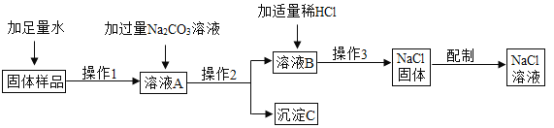
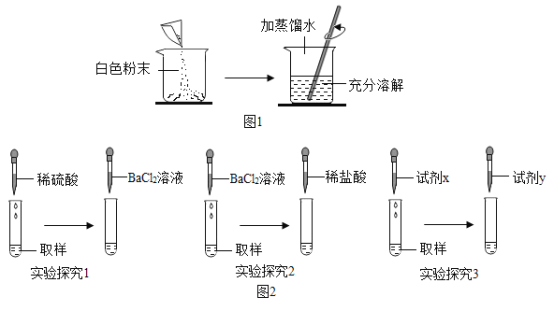
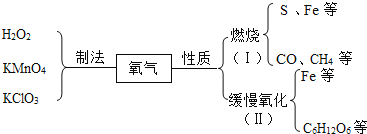
题目内容
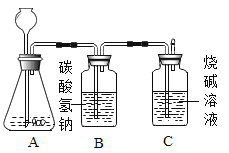
【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
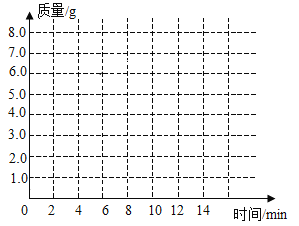
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=______________。
(2)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_______;
(3)计算大理石样品中碳酸钙的质量分数_______。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HC1气体,你认为对测量结果有没有影响_______?
【答案】6.6 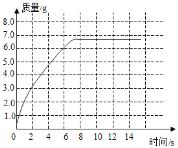 样品中碳酸钙的质量分数为75% 有
样品中碳酸钙的质量分数为75% 有
【解析】
(1)根据碳酸钙与稀盐酸的反应和表中的数据分析;
(2)根据生成的二氧化碳和时间的关系画出能够表明产生气体的质量随时间变化规律的关系曲线;
(3)利用二氧化碳的质量求出碳酸钙的质量,再结合质量分数的计算解决;
(4)根据碳酸氢钠能与盐酸反应放出二氧化碳分析。
(1)由表格知当二氧化碳质量达到6.6g时质量不再增加,也就是二氧化碳的最大量是6.6g,所以,第10分钟时,x=6.6g。
(2)由表中的数据可知,生成的二氧化碳和时间的关系曲线如下:
 。
。
(3)设样品中碳酸钙的质量为x,
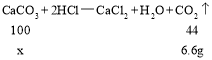
![]()
解得:x=15g
大理石样品中CaCO3的质量分数为![]()
(4)由于碳酸氢钠能与盐酸反应生成了二氧化碳气体,所以B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,对测量结果有影响。
故填:(1)6.6;(2) ;(3)样品中碳酸钙的质量分数为75%;(4)有。
;(3)样品中碳酸钙的质量分数为75%;(4)有。

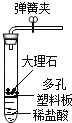
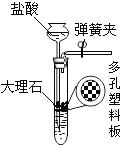
【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究.
【猜想】Ⅰ.氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变.
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变.
Ⅲ.氧化铜是反应的催化剂,反应前后_______________.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如图实验.

(1)填写如表.
步骤③现象 | 步骤⑥现象 | 步骤⑦结果 | 结论 |
_____ | _____ | _____ | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立. |
(2)步骤⑥的目的是______________.
(3)写出该反应的文字表达式:__________________。